-
化学与生活、生产密切相关,下列说法不正确的是( )
A. 纤维素是六大营养素之一,在人体内水解最终生成葡萄糖
B. 用浸泡过高锰酸钾溶液的硅藻土保鲜水果
C. 煤的气化和液化可有效减少煤燃烧产生的污染
D. 硅酸胶体可以用作催化剂载体、食品干燥剂
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. MnO2与足量浓盐酸反应,当生成4.48LCl2时,转移电子数目为0.4NA
B. 7.8gNa2S和Na2O2的混合物中含离子数目为0.3NA
C. 铜的电解精炼过程中,当阳极消耗1molCu时,外电路通过电子数目为2NA
D. 将1mL0.1mol/LFeCl3溶液加入沸水中,形成的Fe(OH)3胶体粒子数目为10-4NA
难度: 中等查看答案及解析
-
有机物A是某种药物的中间体,其结构简式为:
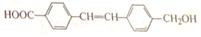 ,关于有机物A的说法正确的是( )
,关于有机物A的说法正确的是( )A. A的分子式为C10H8O3 B. 苯环上的一氯代物有2种
C. 可使酸性KMnO4溶液和溴水褪色 D. 可发生氧化反应、加成反应和消去反应
难度: 简单查看答案及解析
-
下列解释事实的方程式不正确的是( )
A. 金属钠露置在空气中,光亮表面颜色变暗:4Na+O2=2Na2O
B. 硫酸铵溶液与氢氧化钡溶液混合后加热,产生气体:NH4++OH-
NH3↑+H2O
C. 铝条插入烧碱溶液中,开始没有明显现象:Al2O3+2OH-=2AlO2-+H2O
D. 碘化银悬浊液滴加硫化钠溶液,黄色沉淀变成黑色:2AgI+S2-=Ag2S+2I-
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、Q在元素周期表中位置如图所示,四种元素质子数之和为36。R元素原子半经在同周期中最大,且R的单核离子与Z的单核离子电子层结构相同。下列说法正确的是( )
X
Y
Z
Q
A. 离子半径大小顺序:R>Z>Y
B. X与Z、R与Z形成的化合物所含化学键的类型相同
C. 最高价氧化物的水化物酸性强弱顺序:Q>Y>X
D. 最高正价的高低顺序:Y>X>R
难度: 简单查看答案及解析
-
镁-空气电池的总反应方程式为:2Mg+O2+2H2O=2Mg(OH)2,其工作原理如图所示,下列说法不正确是( )

A. 反应过程中化学能转变成电能
B. 该电池的正极反应方程式为O2+4e-+2H2O=4OH-
C. 为防止负极区沉积Mg(OH)2,宜采用中性电解质及阴离子交换膜
D. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
难度: 简单查看答案及解析
-
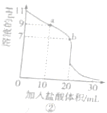
下列关于图示的说法正确的是( )
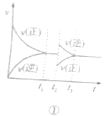


A. 图①可表示恒温恒压条件下充入H2(g)和I2(g),t1时达到平衡,相同条件下t2时又充入一定量HI(g),t3时再次达到平衡
B. 图②表示用0.1000mol/L盐酸滴定20.00mL未知浓度的一元碱MOH溶液的滴定曲线,由此可判断出使用的酸碱指示剂为酚酞
C. 图③表示反应物A的平衡转化率和压强、温度的关系,可以判断可逆反应mA(g)+nB(g)
pC(g) △H>0,且m+n>p
D. 由图④判断除去CuSO4溶液中杂质Fe3+,可向溶液中加入适量固体NaOH,调pH为4左右
难度: 困难查看答案及解析


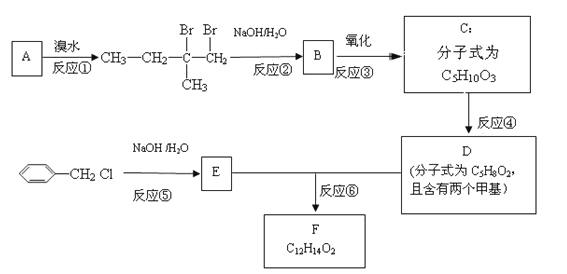
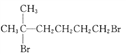 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备
