-
“美丽中国”是十八大提出的重大课题,她突出了生态文明,重点是社会发展与自然环境之间的和谐,下列行为中不符合这一主题的是( )
A.用已脱硫的煤作燃料
B.开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境
C.采用“绿色化学”工艺,使原料尽可能转化为所需要的物质
D.开发利用可燃冰是缓解能源紧缺的唯一途径难度: 中等查看答案及解析
-
下列对有关反应能量变化图象的判断错误的是( )
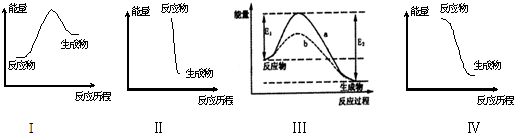
A.I可表示需加热的放热反应
B.Ⅱ可表示爆炸反应
C.Ⅲ可表示无催化剂(a)和有催化剂(b)时反应的能量变化
D.Ⅳ可表示醋酸和碱的中和反应难度: 中等查看答案及解析
-
化学用语是学习化学的重要工具.下列用来表示物质变化的化学用语错误的是( )
A.碳酸钠的水解反应:CO32-+H2O⇌HCO3-+OH-
B.FeCl3水解的离子方程式:Fe3++3H2O⇌Fe (OH)3+3H+
C.稀溶液中强酸与强碱的中和热:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1
D.C不燃烧的热化学方程式为:C(s)+O2(g)=CO(g)△H=110.5kJ•mol-1
难度: 中等查看答案及解析
-
下列离子组一定能大量共存的是( )
A.能使甲基橙变红的溶液中:Na+、NH4+、I-、NO3-
B.含有0.1 mol•L-1Ba2+的溶液中:K+、Mg2+、CO32-、SO42-
C.由水电离出来的c(H+)=1×10-13mol•L-1的溶液中:K+、CH3COO-、Cl-、NO3-
D.常温下,KW/(OH-)=0.1 mol•L-1的溶液:Na+、SO42-、NH4+、NO3-难度: 中等查看答案及解析
-
在电解水时,为了增强导电性,加入的电解质最好选用( )
A.Na2SO4
B.HCl
C.NaCl
D.CuSO4难度: 中等查看答案及解析
-
下列关于电解质溶液说法正确的是( )
A.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应
B..等体积的pH都为3的酸HA和HB分别与足量的Mg反应,HA放出的H2多,说明酸性:HA>HB
C.常温下,弱酸酸式盐NaHA溶液的pH=6,说明HA‾的电离程度大于其水解程度
D.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同难度: 中等查看答案及解析
-
下列对于化学反应方向说法正确的是( )
A.反应2A(g)+B(g)=3C (s)+D(g)在一定条件下能自发进行,说明该反应的△H>0
B.常温下反应2Na2SO3(s)+O2(g)=2Na2SO4(s)能自发进行,则△H<0
C.反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H>0
D.一定温度下,反应2NaCl(s)=2Na(s)+Cl2(g)的△H<0,△S>0难度: 中等查看答案及解析
-
升高温度,下列数据不一定增大的是( )
A.化学反应速率v
B.化学平衡常数K
C.水的离子积常数Kw
D.弱酸的电离常数Ka难度: 中等查看答案及解析
-
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)
CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
A.增加压强
B.降低温度
C.增大CO的浓度
D.更换催化剂难度: 中等查看答案及解析
-
下列对于电化学说法正确的是( )
A.电解精练铜时,阳极泥中常含有金属金、银、锌等
B.为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭
C.充电电池放电时,化学能转变为电能
D.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应难度: 中等查看答案及解析
-
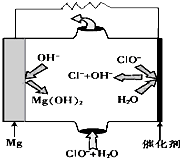
下列关于难溶电解质溶液说法正确的是( )
A.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
B.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol•L-1盐酸、③0.1 mol•L-1氯化镁溶液、④0.1 mol•L-1硝酸银溶液中,Ag+浓度:①>④=②>③
C.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-=Ag2S↓+2Cl-
D.25℃时,在Mg(OH)2悬浊液中加入少量的NH4Cl固体后,c(Mg2+)增大难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是( )
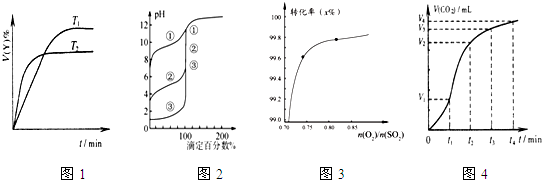
A.图1表示可逆反应“2X(g)⇌Y(g)△H<0”,温度T1<T2的情形
B.用0.1000 mol•L-1NaOH溶液分别滴定浓度相同的三种一元酸,由图2曲线可确定①的酸性最强
C.在其它条件不变时,2SO2(g)+O2(g)⇌2SO3(g)转化关系(如图3)中,纵坐标表示O2的转化率
D.图4表示碳酸钙与盐酸反应收集到气体最多的时间段是t3~t4难度: 中等查看答案及解析
-
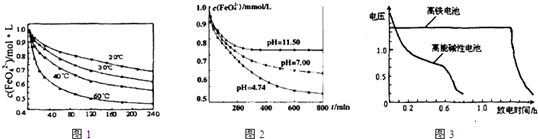
某蓄电池放电、充电时反应为:Fe+Ni2O3+3H2O
Fe(OH)2+2Ni(OH)2下列推断不正确的是( )
A.放电时,Fe为正极,Ni2O3为负极
B.充电时,阴极上的电极反应式是:Fe(OH)2+2e-→Fe+2OH-
C.放电时,负极上的电极反应式是:Ni2O3+3H2O+2e-→2Ni(HO)2+2OH-
D.该蓄电池的电极必须是浸在某种碱性电解质溶液中难度: 中等查看答案及解析
-
下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.1L0.1mol•L-1(NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-)
B.25℃时,等体积、等浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
C.25℃时,BaCO3饱和溶液(Ksp=8.1×10-9):c(Ba2+)=c(CO32-)>c(H+)=c(OH-)
D.1.0 mol•L-1 Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)难度: 中等查看答案及解析
-
一定温度下,在4个容积均为1L的容器中分别进行反应(各容器中A都足量)
A(s)+B(g)⇌C(g)+D(g)△H=+100kJ/mol
某时刻测得部分数据如下表:
下列说法正确的是( )容器编号 n(B)/mol n(C)/mol n(D)/mol 反应时间/min 反应速率 Ⅰ 0.06 0.60 0.10 t1 v(正)=v(逆) Ⅱ 0.12 1.20 0.20 t2 Ⅲ 0.32 1.0 Ⅳ 0.12 0.30 v(正)=v(逆)
A.容器Ⅰ中平均反应速率v(B)=0.04/t1 mol/
B.t2时容器Ⅱ中v(正)>v(逆)
C.容器Ⅲ中反应至平衡时吸热20 kJ
D.容器Ⅳ中c(D)=0.4 mol/L难度: 中等查看答案及解析