-
下列有关环境问题的说法中正确的是 ( )
A.空气质量报告的各项指标中,有二氧化硫、二氧化氮和二氧化碳的指数
B.pH在5.6~7.0之间的降水可通常称为酸雨
C.含氮、磷合成洗涤剂可以被细菌分解,故不会导致水体污染
D.汽车尾气中氮氧化物、一氧化碳、碳氢化合物和颗粒物等,严重污染大气
难度: 中等查看答案及解析
-
下列变化不属于化学变化的是 ( )
A.SO2使品红溶液褪色 B.氯水使有色布条褪色
C.活性炭使红墨水褪色 D.H2O2水溶液使染料褪色
难度: 中等查看答案及解析
-
“化学是实验的科学,只有实验才是最高法庭”(著名化学家付鹰语),下列关于各实验装置图的叙述中,正确的是 ( )

A.装置①常用于分离互不相溶的液体混合物
B.装置②可用于吸收NH3,并防止倒吸
C.以NH4HCO3为原料,装置③可用于实验室制备少量NH3
D.装置④b口进气可收集Cl2、NO等气体
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A.铜 、酒精、冰醋酸分别属于非电解质、电解质、弱电解质
B.碱性氧化物一定是金属氧化物
C.煤的干馏、煤的液化都属于物理变化
D.冰醋酸、碱式碳酸铜、小苏打分别属于酸、碱、盐
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列叙述正确的是 ( )
A.60gSiO2含有的Si—O共价键数为2NA
B.常温常压下,1L1mol/L的亚硫酸钠溶液中的SO32-的个数为NA
C.标准状况下,11.2LSO3所含分子数为0.5NA
D.1.5 mol NO2与足量H2O反应,转移的电子数为NA
难度: 困难查看答案及解析
-
能正确表示下列反应的离子方程式是 ( )
A.溴化亚铁溶液中通入足量氯气:2Fe2++2Br—+2Cl2===2Fe3++Br2+2Cl—
B.向次氯酸钙溶液通入SO2:Ca2++2ClO—+SO2+H2O=== CaSO3↓+2HClO
C.四氧化三铁与稀硝酸反应:Fe3O4+8H+===Fe2++ 2Fe3+ H2O
D.Cl2与石灰水反应:Cl2+2OH-===Cl-+ClO-+H2O
难度: 困难查看答案及解析
-
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的体积相等时,实际参加反应的Cu2S与HNO3的物质的量之比为 ( )
A.1∶7 B.1∶5 C.1∶9 D.2∶9
难度: 中等查看答案及解析
-
下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是 ( )
A.Na和O2 B.NaOH和CO2 C.NaHCO3和NaOH D.Na2CO3和HCl
难度: 中等查看答案及解析
-
X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是 ( )
A.原子半径由小到大的顺序:X< Y < Z< W
B.Z的最高价氧化物能与水反应生成相应的酸
C.Y单质在一定条件下可以与氧化铁发生置换反应
D.室温下,0.1 mol/L W的气态氢化物的水溶液的pH > 1
难度: 困难查看答案及解析
-
250C时,向VmLpH=a的盐酸中滴加pH=b的氢氧化钠溶液10VmL时,溶液中
Cl-的物质的量恰好等于Na+的物质的量,则此时a+b的值为 ( )
A.13 B.14 C.15 D.不能确定
难度: 中等查看答案及解析
-
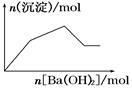
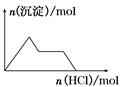
下列示意图与对应的反应情况正确的是( )
A.含0.01 mol KOH和0.01 mol Ca(OH)2 B.NaHSO4溶液中逐滴加入Ba(OH)2溶液
的混合溶液中缓慢通入CO2

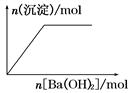
C.KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液 D.NaAlO2溶液中逐滴加入盐酸
难度: 简单查看答案及解析
-
某无色溶液中可能含有①Na+、②Ba2+、③Cl-、④Br-、⑤SO、⑥SO中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下,下列结论正确的是 ( )

A.肯定含有的离子是①④⑤ B.肯定没有的离子是②⑤
C.不能确定的离子是① D.不能确定的离子是③⑤
难度: 简单查看答案及解析
-
查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e-→X+2H+。下列说法中正确的是 ( )
A.电池内部H+由正极向负极移动
B.另一极的电极反应式为:O2 + 4e- + 2H2O = 4OH-
C.乙醇在正极发生反应,电子经过外电路流向负极
D.电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O
难度: 简单查看答案及解析
-
右图是温度和压强对X + Y
2Z 反应影响的示意图图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )。
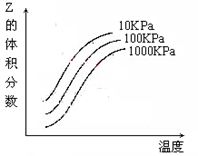
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种是气态,Z为气态
D.上述反应的逆反应的△H>0
难度: 简单查看答案及解析
-
铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mlN2O4(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为( )。
A.8.51g B.8.26g C.7.04g D.9.02g
难度: 简单查看答案及解析
-
下列溶液中微粒的物质的量浓度关系一定正确的是 ( )
A.0.1mol/LNH4Cl溶液与0.05mol/LNaOH溶液等体积混合后所得的碱性溶液中:
c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
B.等物质的量的NaClO、NaHCO3混合溶液中:
c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-)
C.pH=2的HA溶液与pH=12的MOH溶液等体积混合:
c(M+)=c(A-)>c(OH-)=c(H+)
D.某二元弱酸的酸式盐NaHA溶液:c(Na+)+ c(H+)=c(OH-)+c(HA-)+c(A2-)
难度: 简单查看答案及解析