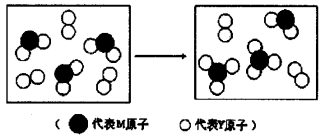
-
下列日常生活中的现象与氧化还原反应无关的是( )
A.铜铸塑像上出现铜绿[Cu2(OH)2CO3]
B.用石膏点豆腐
C.不良商贩用硫黄熏蒸法制作“白豆芽”
D.自来水厂用氯气对水进行消毒
难度: 简单查看答案及解析
-
下图所示的实验,能达到实验目的的是
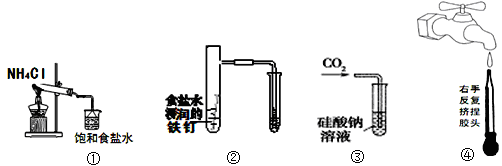
A.实验①制取的氨气溶解在饱和NaCl溶液
B.实验②通过观察右边试管有无倒吸现象说明铁钉是否发生吸氧腐蚀
C.实验③可用于证明碳的非金属性比硅强
D.图④是实验室洗涤胶头滴管的操作
难度: 中等查看答案及解析
-
下列观点正确的是 ( )
A.化合物电离时,生成的阴离子是氢氧根离子的是碱
B.某化合物的熔融状态能导电,该化合物中一定有离子键
C.某化合物的水溶液能导电,该化合物一定是电解质
D.某纯净物在常温下为气体,则组成该物质的微粒一定含有共价键
难度: 中等查看答案及解析
-
利用下列各组物质制备和收集少量相应气体,能采用如图实验装置的是 ( )

①浓氨水与固体CaO ②稀盐酸与石灰石
③稀硝酸与铜片 ④过氧化氢溶液与MnO2
⑤锌粒与稀硫酸 ⑥浓盐酸与MnO2
A.①②⑥ B.②④ C.①②③⑥ D.全部
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是( )
选项
实验操作
实验现象
结 论
A
用铂丝蘸取溶液进行焰色反应
火焰呈黄色
溶液中无K+
B
向溶液中先滴加稀盐酸,再滴加BaCl2溶液
先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀
溶液中一定含有SO42-
C
向某溶液中加入稀盐酸
产生使澄清石灰水变浑浊的气体
溶液中一定含有CO32-
D
向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口
试纸不变蓝
原溶液中无NH4+
难度: 中等查看答案及解析
-
已知A、B、C、X是四种中学化学中常见的物质,其转化关系符合下图。则A和X(要求A和X能互换)不可能是
A.C和O2
B.SO2和NaOH溶液
C.Cl2和Fe
D.AlCl3溶液和NaOH溶液
难度: 中等查看答案及解析
-
铍及其化合物的性质与铝十分相似,下列关于铍及其化合物的推断正确的是
A.铍能与强酸、强碱溶液发生反应 B.氢氧化铍可溶于水
C.氯化铍溶液显中性 D.氧化铍的化学式Be2O3
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.原子最外层电子数为2的元素一定是ⅡA元素
B.第三周期元素对应的离子半径从左往右依次减小
C.第ⅦA族元素从上到下,其氢化物的酸性逐渐减弱
D.第三周期的主族元素的最高正价一定等于其最外层电子数
难度: 简单查看答案及解析
-
美、德两国成功合成具有化学特性的氢铝化合物(AlH3)n,关于氢铝化合物的推测不正确的是
A.氢铝化合物与水反应生成氢氧化铝和氢气
B.与H2O反应生成2.24 LH2(标况下),转移的电子为0.2 mol
C.氢铝化合物中氢显-1价
D.氢铝化合物具有强还原性
难度: 中等查看答案及解析
-
主族元素X在周期表中位于第二周期,其原子最外层电子数大于4,元素Y在周期表中位于第三周期,其原子最外层电子数小于4,有关其说法正确的是( )
A.X所形成的单质都是双原子分子
B.原子半径X>Y
C.X、Y能形成的阴、阳离子数之比为1:2离子化合物,其一定为碱性氧化物
D.由X、Y组成的某化合物与水反应能生成一种强碱和一种弱碱,其简单离子半径:X>Y
难度: 中等查看答案及解析
-
下列两种方案制备氢氧化铝:
方案一:2.7g Al
X溶液
Al(OH)3沉淀
方案二:2.7g Al
Y溶液
Al(OH)3沉淀
已知所用的稀盐酸与NaOH溶液均为3mol/L.图是向X溶液与Y溶液中分别加入NaOH溶液或稀盐酸时产生沉淀的质量与加入溶液体积之间的关系.相关说法正确的是

A.a曲线表示的是向Y溶液中加入NaOH溶液
B.方案二比方案一生成更多的气体
C.在M点时,两种方案中所得溶液的溶质质量分数相同
D.M点以后,a、b两条曲线将重合为一条
难度: 困难查看答案及解析
-
为精确测定工业纯碱中碳酸钠的质量分数(含少量NaCl),准确称量W0 g样品进行实验,下列实验方法所对应的实验方案和测量数据最合理(除W0外)的是
实验方法
实验方案
测量数据
A.
滴定法
将样品配成100 mL溶液,取10 mL,加入甲基橙,
用标准盐酸滴定
消耗盐酸的体积
B.
量气法
将样品与盐酸反应,生成的气体全部被碱石灰吸收
碱石灰增重
C.
重量法
样品放入烧瓶中,置于天平上,加入足量盐酸
减轻的质量
D.
量气法
将样品与盐酸反应,气体通过排水量气装置量气
排水体积
难度: 中等查看答案及解析
-
X、Y、Z三种短周期元素,原子半径的大小关系为:r(y)>r(x)>r(z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生下图所示变化,其中B和C均为10电子分子。下列说法不正确的是

A.X元素位于ⅥA
B.A不能溶解于B中
C.B的沸点高于C的沸点
D.A和C不可能发生氧化还原反应
难度: 中等查看答案及解析
-
元素X~Z是元素周期表中4种主族元素,其性质或结构信息如下表,有关下列元素的描述错误的是
元素
X
Y
W
Z
相关信息
用硫酸处理海藻灰时,可得通常状况下为紫黑色的固体,其制剂可用来消毒
工业上在冰晶石存在的条件下,用电解法制取其单质
最早是在用氯气处理提取食盐后的盐水母液中发现的,被称作“海洋元素”
原子的电子总数是最外层电子数的6倍
A.实验室可在海藻灰的浸出液中滴加双氧水来制取元素X的单质
B.元素X、Y的单质充分混合后滴加少量水,可看到大量紫色蒸汽生成,说明该反应会放出大量的热
C.元素X的气态氢化物的沸点高于元素W的气态氢化物的沸点
D.元素Z是一种较活泼的金属元素,可用铝热法从Z的氧化物中制备Z的单质
难度: 中等查看答案及解析
-
某溶液可能含有Al3+、NH4+、Fe2+、Na+、CO32-、SO42-、Cl-、NO3-中的若干种。若在该溶液中逐滴加入稀盐酸至过量无明显现象,并得到X溶液,对X溶液进行如下实验:(已知该题忽略水的电离,且原溶液中各离子浓度均为0.5mol•L-1)
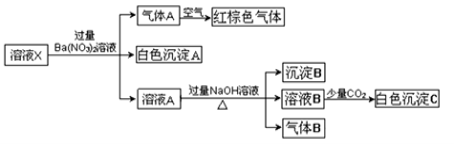
下列结论正确的是
A.原溶液中可能含有NO3-和Al3+
B.原溶液中一定存在NH4+、Fe2+、SO42-、Cl-
C.沉淀B可能是Fe(OH)2和Fe(OH)3的混合物
D.白色沉淀C可能是Al(OH)3
难度: 困难查看答案及解析
-
将11.9 g由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀HNO3中,生成了6.72 L NO(标准状况下),向反应后的溶液中加入适量的NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为( )
A.22.1 g B.27.2 g C.30g D.无法计算
难度: 中等查看答案及解析