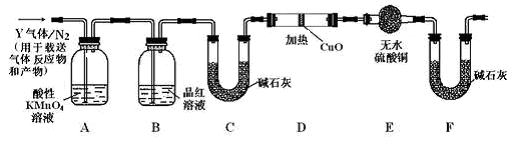-
(16分)工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)第一步:将已去除表面氧化物的铁钉(含少量碳元素)放入冷浓硫酸中,第二步:10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面 (填写第二步的实验现象,若有则写出具体现象,若无则写无明显变化),其原因是___________ ______。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热充分反应后得到溶液X并收集到气体Y。
① 甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中有Fe2+,应先用________(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.酸性KMnO4溶液 d.浓氨水
铁粉与溶液X反应可制得一种补血剂, 写出其离子方程式 。
② 乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4,
然后加入足量 BaCl2溶液,经适当操作后得到干燥固体2.33g。由此推知气体Y中SO2的体积分数为__________________。
[探究二]分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。

(3)装置B中试剂的作用是____________。
(4)认为气体Y中还含有Q的理由是__________(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于__________(填序号)。
a.A之前 b. A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是_________________ __
-
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)第一步:将已去除表面氧化物的铁钉(含少量碳元素)放入冷浓硫酸中,
第二步:10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面
其原因是___________ ______。
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热充分反应后得到溶液X并收集到气体Y。取336mL(标准状况)气体Y通入足量溴水中,发生反应:________ _____,然后加入足量 BaCl2溶液,经适当操作后得到干燥固体2.33g。由此推知气体Y中SO2的体积分数为__________________。
[探究二]分析上述实验中SO2体积分数的结果,学习小组同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。

(3)装置B中试剂的作用是____________。
(4)认为气体Y中还含有Q的理由是__________(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于__________(填序号)。
a.A之前 b. A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是_________________ __
-
工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]已去除表面氧化物的铁钉(碳素钢)放入浓硫酸中,加热,充分反应后收集到气体Y。某同学认为气体Y中除了SO2外还可能含有H2和CO2气体,为此设计了下列实验装置,探究Y中H2和CO2的存在(图中夹持仪器省略)。
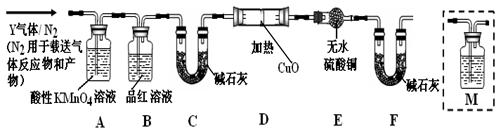
(1)装置B中试剂的作用是________。
(2)认为气体Y中还含有CO2的理由是________(用化学方程式表示)。
(3)为确认CO2的存在,需在装置中添加M于________(选填序号)。
a.. A之前 b . A-B间 c . B-C间 d . C-D间
(4)如果气体Y中含有H2,预计实验现象应是________。
[探究二] SO2气体还原Fe3+、I2,使用的药品和装置如下图所示: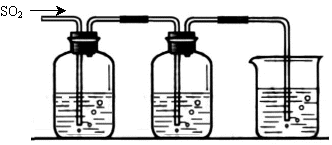
FeCl3溶液 含有淀粉的碘水 NaOH溶液
A B C
(5)装置C的作用是 ________ ________。
(6)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发浓缩、冷却结晶、 、洗涤、自然干燥,在这一系列操作中没有用到的仪器有 ________ (填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F. 坩埚
(7)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 原因是 ________(8)能表明I-的还原性弱于SO2的现象是 。
-
(9分) 工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究过程]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是________。
(2)另称取铁钉6.0g放入15.0ml.浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应先用________(选填序号)。
a.铁粉和KSCN溶液 b. 酸性溶液 c.浓氨水 d.KSCN溶液和氯水
酸性溶液 c.浓氨水 d.KSCN溶液和氯水
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应SO2+Br2+2H2O=2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为________。
-
(16分)工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
【探究一】
(1)将已去除表面氧化物 的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是___________
的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是___________
(2)另称取铁钉6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+ 。若要确认其中的Fe2+应选用________(选填序号)。
。若要确认其中的Fe2+应选用________(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.KMnO4 酸性溶液
酸性溶液
②乙同学取336 mL(标准状况)气体Y通入足量溴水中,发生反应:[SO2+Br2+2H2O=2HBr+H2SO4 然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为________。
【探究二】
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
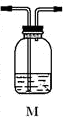
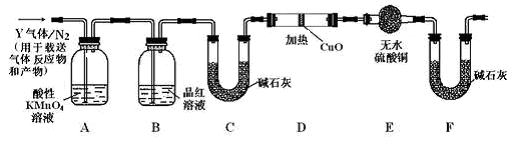
(3)装置B中试剂的作用是___________________
(4)认为气体Y中还含有Q的理由是________________(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于________(选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是__________
(7)若要测定336mL气体中H2的含量(标准状况下约有28 mL H2),可否用托盘天平称量D或E反应前后的质量差的方法?做出判断并说明理由__________
-
(13分)
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
【探究一】
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是_____________________
(2)另称取铁钉6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+应选用___________(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.KMnO4酸性溶液
②乙同学取336 mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O===2HBr+H2SO4 然后加入足量BaCl2溶液,经__________________操作后得固体2.33 g。由此推知气体Y中SO2的体积分数为______________。
【探究二】
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
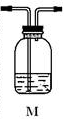
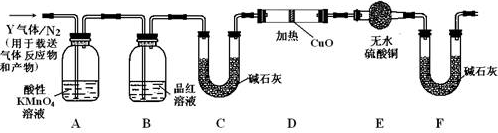
(3)装置B中试剂的作用是_____________________
(4)认为气体Y中还含有Q的理由是________________(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于_________________(选填序号)。
a.A之前 b.A-B间
c.B-C间 d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是__________________
(7)若要测定336mL气体中H2的含量(标准状况下约有28 mL H2),可否用托盘天平称量D或E反应前后的质量差的方法?做出判断并说明理由__________________
-
工业上常用铁质容器盛装冷浓酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是______.
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+.若要确认其中的Fe2+,应先用______选填序号).
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O═2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由于此推知气体Y中SO2的体积分数为______.
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和Q气体.为此设计了下列探究实验状置(图中夹持仪器省略).
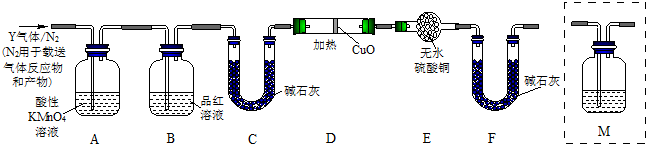
(3)装置B中试剂的作用是______.
(4)认为气体Y中还含有Q的理由是______ CO2 ↑+2SO2↑+2H2O
-
工业上常用铁质容器盛装冷浓酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是______.
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+.若要确认其中的Fe2+,应先用______选填序号).
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O═2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由于此推知气体Y中SO2的体积分数为______.
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和Q气体.为此设计了下列探究实验状置(图中夹持仪器省略).

(3)装置B中试剂的作用是______.
(4)认为气体Y中还含有Q的理由是______ CO2 ↑+2SO2↑+2H2O
-
工业上常用铁质容器盛装冷浓酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是______.
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+.若要确认其中的Fe2+,应先用______选填序号).
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O═2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由于此推知气体Y中SO2的体积分数为______.
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和Q气体.为此设计了下列探究实验状置(图中夹持仪器省略).
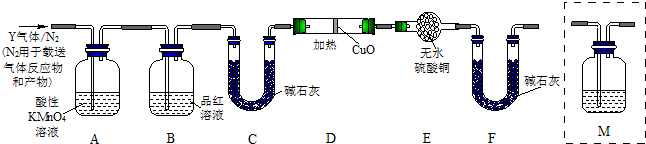
(3)装置B中试剂的作用是______.
(4)认为气体Y中还含有Q的理由是______ CO2 ↑+2SO2↑+2H2O
-
工业上常用铁质容器盛装冷浓酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是______.
(2)另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+.若要确认其中的Fe2+,应先用______选填序号).
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O═2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由于此推知气体Y中SO2的体积分数为______.
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和Q气体.为此设计了下列探究实验状置(图中夹持仪器省略).
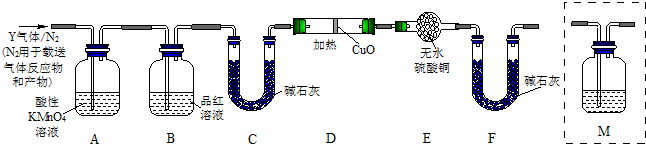
(3)装置B中试剂的作用是______.
(4)认为气体Y中还含有Q的理由是______ CO2 ↑+2SO2↑+2H2O