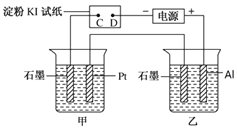
-
下列各组中的物质均能发生加成反应的是
A. 乙烯和乙醇 B. 苯和氯乙烯 C. 乙酸和溴乙烷 D. 丙烯和丙烷
难度: 简单查看答案及解析
-
下列说法中不正确的是( )
A. 分子组成相差一个或几个
原子团的有机物不一定是同系物
B. 乙烯、聚氯乙烯结构中都含有碳碳双键
C.
只有一种结构说明甲烷分子是正四面体结构,而不是平面正方形结构
D. 分子中仅含有碳、氢元素的化合物是烃
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 难溶电解质作比较时,KSP小的,溶解度一定小
B. KSP大小取决于难溶电解质的溶解度,所以离子浓度改变时KSP会发生变化
C. 所谓沉淀完全就是用沉淀剂将溶液中某一离子完全除去
D. 温度一定,当溶液中Ag+和Cl—浓度的乘积等KSP时,溶液为AgCl的饱和溶液
难度: 中等查看答案及解析
-
下列按纯净物、混合物、电解质和非电解质顺序排列的是( )
A. 盐酸、空气、醋酸、干冰 B. 冰醋酸、水玻璃、硫酸钠、乙醇
C. 液氯、碱石灰、苛性钾、石灰石 D. 胆矾、漂白粉、氯化钾、硫酸钡
难度: 中等查看答案及解析
-
常温下,某溶液中由水电离的c(H+)=1×10-13 mol/L,该溶液可能是 ( )
①二氧化硫水溶液 ②氯化铵水溶液 ③碳酸钠水溶液 ④氢氧化钠水溶液
A. ①② B. ②③ C. ①④ D. ③④
难度: 中等查看答案及解析
-
浓度均为0.1 mol / L的①NaHCO3、②Na2CO3、③NaCl、④NaHSO4四种溶液,按pH值由小到大排列的顺序是
A. ①②③④ B.④③①② C.③④①② D.②①④③
难度: 中等查看答案及解析
-
某学生的实验报告所列出的下列数据中合理的是( )
A. 用酸式滴定管量取13.17mL稀盐酸
B. 用10mL量筒量取7.13mL稀盐酸
C. 用广泛pH试纸测得某溶液的pH为2.3
D. 用天平称取物品的质量为5.872g
难度: 中等查看答案及解析
-
10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的是 ( )
A. H2SO4 B. CuSO4 C. CH3COONa D. Na2CO3
难度: 中等查看答案及解析
-
25 ℃时,水的电离达到平衡:H2O
H++OH- ΔH>0,下列叙述正确的是( )
A. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C. 向水中加入少量CH3COOH,平衡逆向移动,c(H+)降低
D. 将水加热,Kw增大,pH不变
难度: 中等查看答案及解析
-
0.1mol下列气体分别与1L0.lmol·L-1的NaOH溶液反应,形成的溶液pH最小的是( )
A. NO2 B. SO2 C. SO3 D. CO2
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A. 植物油氢化过程中发生了加成反应
B. 淀粉和纤维素互为同分异构体
C. 己烷与苯可用酸性KMnO4溶液鉴别
D. 水可以用来分离溴苯和苯的混合物
难度: 中等查看答案及解析
-
锌−空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O===2Zn(OH)42-。下列说法正确的是( )
A. 放电时,负极反应为:Zn+4OH–-2e–===Zn(OH)42-
B. 充电时,电解质溶液中c(OH-)逐渐减小
C. 充电时,电解质溶液中K+向阳极移动
D. 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是
A. 向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中
 减小
减小B. 将CH3COONa溶液从20℃升温至30℃,溶液中
 增大
增大C. 向盐酸中加入氨水至中性,溶液中
>1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中不
变
难度: 困难查看答案及解析
-
能证明乙酸是弱酸的实验事实是
A. CH3COOH溶液与Zn反应放出H2
B. 0.lmol/LCH3COOH溶液可使紫色石蕊变红
C. CH3COOH溶液与Na2C03反应生成C02
D. O.lmol/LCH3COONa溶液的pH大于7
难度: 中等查看答案及解析
-
下列下列说法不正确的是 ( )
A. 铅蓄电池放电时正极的工作原理为:PbO2+4H++SO42-+2e-═PbSO4+2H2O,其充电时阴极的反应式:PbSO4+2e-═Pb+SO42-
B. 碱性锌锰干电池放电时,负极反应式:Zn-2e-═Zn2+
C. 碱性镍氢电池放电时负极反应式:H2-2e-+2OH-═2H2O
D. 某锂离子电池的总反应式为:Li+2Li0.35NiO2
2Li0.85NiO2,则其充电时阳极反应式为:2Li0.85NiO2-e-═2Li0.35NiO2+Li+
难度: 中等查看答案及解析
-
用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为
混合溶液。下列叙述错误的是 ( )
A. 待加工铝质工件为阳极 B. 可选用不锈钢网作为阴极
C. 阴极的电极反应式为:
D. 硫酸根离子在电解过程中向阳极移动
难度: 中等查看答案及解析
-
下列溶液中粒子的物质的量浓度关系正确的是( )
A. 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)
B. 20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C. 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-)
D. 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)
难度: 困难查看答案及解析
-
室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是( )
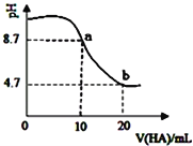
A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) B. a、b两点所示溶液中水的电离程度相同
C. pH=7时,c(Na+)=c(A-)+c(HA) D. b点所示溶液中c(A-)>c(HA)
难度: 简单查看答案及解析