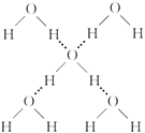
-
下列表达方式错误的是
A.CO2的分子模型示意图:
B.甲烷的电子式:
C.硫离子的核外电子排布式:1s22s22p63s23p6
D.碳-12原子构成:
C
难度: 简单查看答案及解析
-
用铂丝蘸取氯化钠溶液在酒精灯上灼烧,火焰呈现黄色,显色原因是
A.氯化钠受热挥发 B.氯化钠受热分解
C.钠离子中电子跃迁 D.氯离子中电子跃迁
难度: 简单查看答案及解析
-
下列各含氧酸中酸性最强的是
A.H2SeO3 B.HMnO4 C. H3BO3 D. H3PO4
难度: 中等查看答案及解析
-
下列化学方程式中有一个与其他三个在分类上不同,这个反应是
A.3Fe+2O2
Fe3O4 B.C+ O2
2CO
C.NH4HCO3
NH3↑+H2O+CO2↑ D.Na2CO3++H2O+CO2=2 NaHCO3
难度: 简单查看答案及解析
-
下列说法错误的是
A.明矾水解时产生具有吸附性的胶体粒子,可作漂白剂
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.“血液透析”利用了胶体的性质
D.葡萄糖注射液不能产生丁达尔现象,不属于胶体
难度: 简单查看答案及解析
-
在基态多电子原子中,关于核外电子能量的叙述错误的是
A.最易失去的电子能量最高
B.电离能最小的电子能量最高
C.p轨道电子能量一定高于s轨道电子能量
D.在离核最近区域内运动的电子能量最低
难度: 简单查看答案及解析
-
下列四种晶体,它们的熔点按由低到高的顺序排列正确的是
①金刚石 ②氯化钠 ③干冰 ④钠
A.④②③① B.③①②④ C.④②①③ D.③④②①
难度: 简单查看答案及解析
-
金属晶体、离子晶体、分子晶体和原子晶体的根本区别是
A.基本构成微粒和微粒间的作用力不同
B.外部形状不同
C.金属晶体和原子晶体属于单质,分子晶体和离子晶体属于化合物
D.基本构成微粒做周期性重复排列所遵循的规律不同
难度: 简单查看答案及解析
-
具有下列电子层结构的原子和离子,其对应元素一定属于同一周期的是
A.两原子核外全部都是s电子
B.最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子
C.原子核外M层上的s、p能级都充满电子,而d能级上没有电子的两种原子
D.两原子N层上都有1个s电子,一个原子有d电子,另一个原子无d电子
难度: 中等查看答案及解析
-
下列各组分子或离子中,中心原子的杂化轨道类型相同的是
A.CO2与NO2 B.PCl3和BF3C.CO32-与SO32- D.CH4和SO42-
难度: 中等查看答案及解析
-
下列有关化学键与晶体结构的说法正确的是
A.由两种元素组成的分子中一定只有极性键
B.离子化合物的熔点一定比共价化合物的高
C.由非金属元素组成的化合物一定是共价化合物
D.含有阴离子的化合物一定有阳离子
难度: 简单查看答案及解析
-
石墨烯(Graphene)是目前已知的世界上最薄、最坚硬、导电性最好的纳米材料,几乎完全透明,具有极好的应用前景。英国曼彻斯特大学的Andre Geim教授和他的学生Konstantin Novoselov因发现石墨烯而获得2010年诺贝尔物理学奖。石墨烯可由石墨剥离而成,为单层片状结构,其结构如图所示。下列说法正确的是
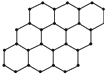
A.石墨烯与石墨互为同位素
B.石墨烯是一种能发生加成反应的有机化合物
C.石墨烯中的碳原子均为sp2杂化
D.12 g石墨烯中含有3 mol σ键
难度: 中等查看答案及解析
-
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF。下列有关说法正确的是
A.NF3是氧化剂,H2O是还原剂
B.还原剂与氧化剂的物质的量之比为2∶1
C.若生成0.2 mol HNO3,则转移0.2 mol电子
D.NF3在潮湿的空气中泄漏会产生红棕色气体
难度: 中等查看答案及解析
-
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,下列说法正确的是
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
难度: 简单查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4; ②1s22s22p63s23p3; ③1s22s22p3; ④1s22s22p5。
则下列有关比较中正确的是
A.第一电离能:④>③>②>① B.原子半径:④>③>②>①
C.电负性:④>③>②>① D.最高正化合价:④>③=②>①
难度: 简单查看答案及解析
-
已知X、Y是主族元素,I为电离能,单位是kJ/mol。根据下表所列数据判断,错误的是
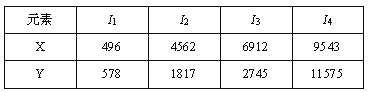
A. 元素X的常见化合价是+1价
B.元素Y是IIIA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应
难度: 中等查看答案及解析
-
相同溶质的两份溶液,一份质量分数为ω1,密度为ρ1 g/cm3,浓度为a mol/L,另一份质量分数为ω2,密度为ρ2 g/cm3,浓度为b mol/L,若2a=b,2ω1>ω2,则ρ1与ρ2的大小关系是
A.ρ1=ρ2 B.ρ1>ρ2 C.ρ1<ρ2 D.无法比较
难度: 中等查看答案及解析
-
某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物,当参加反应的单质与被还原HNO3的物质的量之比为2∶1时,还原产物可能是
A.N2O B.NO C.NO2 D.N2
难度: 中等查看答案及解析
-
向含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中错误的是
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
难度: 困难查看答案及解析