-
化学与生产、生活、环境等社会实际密切相关。下列叙述正确的是
A.“滴水石穿、绳锯木断”不涉及化学变化
B.明矾净水的原理和“84”消毒液消毒的原理不相同
C.氟利昂作制冷剂会加剧雾霾天气的形成
D.汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的
难度: 简单查看答案及解析
-
下列关于化学用语的表示正确的是
A.制备Fe(OH)3胶体:Fe3++3H2O
Fe(OH)3(胶体)+3H+
B.乙醇的结构简式:C2H6O
C.CO2的比例模型:
D.质子数为8,质量数为17的原子:
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的数值。下列说法不正确的是
A.0.05 mol液态KHSO4中含有0.05 NA个阳离子
B.氢氧燃料电池正极消耗22.4 L气体时,电路中通过电子的数目为4 NA
C.常温下,100 mL 1 mol•L-l盐酸与4.6 g钠反应生成H2分子数目为0.1NA
D.在电解精炼粗铜的过程中,当阴极析出32 g铜时转移电子数目为NA
难度: 困难查看答案及解析
-
白屈菜有止痛、止咳等功效,从其中提取的白屈菜酸的结构简式如图。下列有关白屈菜酸的说法中,不正确的是
A.分子式是C7H4O6
B.能发生加成反应
C.能发生水解反应
D.能发生缩聚反应
难度: 中等查看答案及解析
-
下列实验操作中,不正确的是
A.用分液漏斗分离除去溴苯中混入的溴
B.用渗析法除去Fe(OH)3胶体中的Cl-离子
C.除去溴乙烷中的乙醇,用水洗后,再用分液漏斗分离
D.用盐析法分离硬脂酸钠和甘油
难度: 中等查看答案及解析
-
分子式为C5H10O3的有机物与NaHCO3溶液反应时,生成C5H9O3Na;而与金属钠反应时生成C5H8O3Na2。则与该有机物具有相同官能团的同分异构体的种类(不考虑立体异构)有
A.10种 B.11种 C.12种 D.13种
难度: 困难查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.使苯酚显紫色的溶液:NH4+、K+、SCN-、SO42-
B.使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3-
C.由水电离的c(OH-)=10-13mol•L-1的溶液中:Na+、Cl-、CO32-、NO3-
D.c(Fe2+)=1.0 mol•L-1溶液:H+、K+、Cl-、NO3-
难度: 中等查看答案及解析
-
下列有关实验装置进行的相应实验,能达到实验目的的是

A.用图1装置制取并收集干燥的NH3
B.用图2所示装置可除去NO2中的NO
C.用图3所示装置可分离CH3COOC2H5和饱和碳酸钠溶液
D.用图4装置制备Fe(OH)2并能较长时间观察其颜色
难度: 中等查看答案及解析
-
X、Y、Z、W、R属于短周期主族元素。X的原子半径是短周期主族元素中最大的,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1。下列叙述错误的是
A. X与Y形成的两种化合物中阴、阳离子的个数比均为1∶2
B. Y的氢化物比R的氢化物稳定,熔沸点高
C. Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z
D. RY2、WY2通入BaCl2溶液中均有白色沉淀生成
难度: 中等查看答案及解析
-
在密闭容器中,反应2X(g)+ Y2(g)
2XY(g) △H<0,达到甲平衡。在仅改
变某一条件后,达到乙平衡,下列分析正确的是

A.图I中,甲、乙的平衡常数分别为K1、K2,则K1<K2
B.图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低
C.图Ⅱ中,t时间是增大了压强
D.图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲
难度: 中等查看答案及解析
-
20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g·L-1)如右图所示。下列叙述正确的是

A.盐酸浓度越大,Ksp(PbCl2)越大
B.PbCl2能与一定浓度的盐酸反应
C.x、y两点对应的溶液中c(Pb2+)相等
D.往含Pb2+的溶液中加入过量浓盐酸,可将Pb2+完全转化为PbCl2(s)
难度: 困难查看答案及解析
-
把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )mol/L
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.向明矾溶液中加入足量的烧碱溶液: Al3+ + 3OH-= Al(OH)3↓
B.在含有等物质的量的Fe(NO3) 2和KI组成的混合溶液中滴入稀盐酸:3Fe2+ + 4H+ + NO3-=3Fe3+ + NO↑ + 2H2O
C.碳酸氢铵溶液中滴加足量的NaOH溶液:HCO3-+ OH-= CO32- + H2O
D.纯碱溶液呈碱性的原因:CO32-+H2O
HCO3-+OH-
难度: 中等查看答案及解析
-
将V1 mL 1.00 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是

A.做该实验时环境温度为22℃
B.NaOH溶液的浓度约为1.00 mol/L
C.该实验表明有水生成的反应都是放热反应
D.该实验表明化学能可以转化为热能
难度: 中等查看答案及解析
-
一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),进行反应,
2SO2+O2
2SO3,其起始物质的量及SO2的平衡转化率如下表所示。下列判断中正确的是
甲
乙
丙
丁
密闭容器体积/L
2
2
2
1
起始物质的量
n(SO2)/mol
0.40
0.80
0.80
0.40
n(O2)/mol
0.24
0.24
0.48
0.24
SO2的平衡转化率%
80
1
2
3
A.甲中反应的平衡常数小于乙
B.该温度下,该反应的平衡常数K为400
C.SO2的平衡转化率:
1>
2 =
3
D.容器中SO3的物质的量浓度:丙=丁<甲
难度: 困难查看答案及解析
-
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中不正确的是

A.还原剂是含CN-的物质,氧化产物不只有N2
B.氧化剂是ClO-,还原产物是HCO3-
C.参与反应的氧化剂与还原剂的物质的量之比为5:2
D.标准状况下若生成2.24LN2则转移电子为1mol
难度: 困难查看答案及解析
-
根据下图所给信息,得出的结论正确的是

A.碳的燃烧热为b kJ/mol
B.2C(s) + O2(g) = 2CO(g) △H = -2(b-a) kJ/mol
C.2CO2(s) = 2CO(g)+O2(g) △H = +a kJ/mol
D.C(s) + O2(g) = CO2(g) △H < -b kJ/mol
难度: 中等查看答案及解析
-
甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(部分产物已略去),下列各组物质中不能按图示关系转化的是
选项
物质转化关系
甲
乙
丙
丁
A

NaOH
NaHCO3
Na2CO3
CO2
B
AlCl3
NaAlO2
Al(OH)3
NaOH
C
Fe
Fe(NO3)3
Fe(NO3)2
HNO3
D
C
CO
CO2
O2
难度: 中等查看答案及解析
-
下列说法不正确的是
A.将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸
B.相同pH的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa)
C.0.1 mol/L的NaHA溶液pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A)
D.向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
难度: 中等查看答案及解析
-
以乙烷燃料电池为电源进行电解的实验装置如图所示。下列说法正确的是
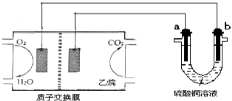
A.燃料电池工作时,正极反应为O2+2H2O+4e-═ 4OH-
B.a极是铜,b极是铁时,硫酸铜溶液浓度减小
C.a、b两极若是石墨,在同温同压下a极产生的气体与电池中消耗的乙烷体积的比为7/2
D.a极是纯铜,b极是粗铜时,a极上有铜析出,b极逐渐溶解,两极质量变化相同
难度: 中等查看答案及解析