-
下列说法正确的是( )
A.物质的化学变化都伴随着能量变化
B.凡是吸热反应都需要加热
C.表示中和热的热化学方程式:NaOH+HCl═NaCl+H2O △H=﹣57.3 kJ•mol﹣1
D.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多
难度: 中等查看答案及解析
-
下列物质中属于电解质,但在给定条件下不能导电的是( )
A.液态溴化氢 B.液氨 C.铝 D.稀硝酸
难度: 简单查看答案及解析
-
下列电离方程式,不正确的是( )
A.KOH ═ K++OH- B.NaHCO3
Na++HCO3-
C.NH3•H2O
NH4++OH- D.CH3COOH
CH3COO-+H+
难度: 中等查看答案及解析
-
250 ℃和1.01×105 Pa时,反应2N2O5(g) == 4NO2(g)+O2(g) ΔH=+56.76 kJ/mol,自发进行的原因是( )
A.是吸热反应 B.是放热反应
C.是熵减少的反应 D.熵增大效应大于能量效应
难度: 中等查看答案及解析
-
已知溶液中存在平衡:Ca(OH)2 (s)
Ca2+(aq)+2OH-(aq) ΔH<0。下列有关该平衡体系的叙述正确的是( )
A.升高温度,固体的量减少
B.加入少量Na2CO3粉末能增大钙离子的浓度
C.降低温度,溶液中c(OH-)增大
D.恒温下加入少量CaO,溶液的pH增大
难度: 中等查看答案及解析
-
已知:2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ•mol﹣1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=﹣1452kJ•mol﹣1
H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ•mol﹣1
下列说法正确的是()
A.H2(g)的燃烧热为571.6kJ•mol﹣1
B.0.5H2SO4(aq)+0.5Ba(OH)2(aq)═0.5BaSO4(s)+H2O(l)△H=﹣57.3kJ•mol﹣1
C.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
D.3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4kJ•mol﹣1
难度: 中等查看答案及解析
-
某学生的实验报告所列出的下列数据中合理的是( )
A.用10mL量筒量取7.13mL稀盐酸
B.用托盘天平称量25.20gNaCl
C.用pH试纸测得某溶液的pH为2.3
D.中和滴定时用去某浓度的碱溶液21.70mL
难度: 简单查看答案及解析
-
某可逆反应过程的能量变化如图所示,下列说法正确的是( )
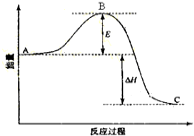
A.该反应过程为吸热反应
B.若加入催化剂,B点会降低
C.若加入催化剂,△H数值会减小
D.若升高温度,则平衡向正反应方向移动
难度: 中等查看答案及解析
-
下列有关化学平衡常数K的说法中,正确的是( )
A.K的大小与起始浓度有关
B.温度越高,K值越大
C.K值越大,反应物的转化率越大
D.K值越大,正向反应进行的程度越小
难度: 中等查看答案及解析
-
25 ℃时,在等体积的①pH=0的H2SO4溶液,②0.05 mol·L-1的Ba(OH)2溶液中,发生电离的水的物质的量之比是( )
A.1∶10 B.1∶5 C.1∶20 D.1∶10
难度: 中等查看答案及解析
-
100℃时,将0.1 mol N2O4置于1 L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是
A.N2O4的消耗速率与NO2的生成速率之比为1∶2;
B.烧瓶内气体的颜色不再加深;
C.烧瓶内气体的平均相对分子质量不再变化;
D.烧瓶内气体的压强不再变化。
难度: 中等查看答案及解析
-
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)⇌Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
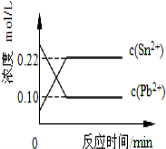
A.往平衡体系中加入金属铅后,C(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0
D.25℃时,该反应的平衡常数K=2.2
难度: 中等查看答案及解析
-
在2 L的密闭容器中,发生以下反应:2A(g) + B(g)
2C(g) + D(g)。若最初加入的A和B都是3 mol,在前10 s A的化学反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是
A.0.6 mol B.1.2 mol C.2.4 mol D.1.8 mol
难度: 中等查看答案及解析
-
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中c(CH3COOH)/c(H+)值减小
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
难度: 中等查看答案及解析
-
下列措施或事实不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅(Cl2+H2O
Cl-+HClO+H+)
B.H2、I2、HI平衡混合气加压后颜色变深
C.在合成氨的反应中,降温或加压有利于氨的合成
D.Fe(SCN)3溶液中加入6mol/LNaOH溶液后颜色变浅
难度: 中等查看答案及解析
-
在四个不同的容器中,在不同的条件下进行合成氨反应.根据在相同时间内测定的结果判断,生成氨的速率最快的是( )
A.v(H2)=0.1 mol•L﹣1•min﹣1 B. v(N2)=0.2 mol•L﹣1•min﹣1
C.v(NH3)=0.15 D. v(H2)=0.3 mol•L﹣1•min﹣1
难度: 中等查看答案及解析
-
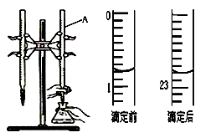
某同学按照课本实验要求,用50mL 0.50mol•L﹣1的盐酸与50mL 0.55mol•L﹣1的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应 过程中所放出的热量计算中和热.下列说法中,正确的是( )
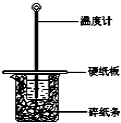
A.实验过程中没有热量损失
B.烧杯间填满碎纸条的作用是固定小烧杯
C.图中实验装置缺少环形玻璃搅拌棒
D.若烧杯上不盖硬纸板,测得的△H将偏小
难度: 中等查看答案及解析
-
100mL浓度为2mol/L的盐酸跟略过量的锌片反应,为减慢反应速率,又不影响生成氢气的总量,可采用的方法是( )
A.加入适量的6mol/L的盐酸 B.加入数滴氯化铜溶液
C.加入适量醋酸钠溶液 D.加入适量的NaOH固体
难度: 中等查看答案及解析
-
将纯水加热至较高温度,下列叙述正确的是
A、Kw变大、pH变小、呈酸性 B、Kw变大、pH不变、呈中性
C、Kw变小、pH变大、呈碱性 D、Kw变大、pH变小、呈中性
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.0.1mol/LCH3COOH溶液加水稀释,溶液中c(OH-)增大
B.将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的1/2
C.相同浓度的HCl和CH3COOH,两溶液中c(H+)相同
D.甲溶液的pH是5,乙溶液的pH是4,则甲溶液与乙溶液的中c(H+)之比为10:1
难度: 中等查看答案及解析
-
已知反应:2CH3COCH3(l)⇌CH3COCH2COH(CH3)2(l).取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y﹣t)如图所示.下列说法正确的是( )
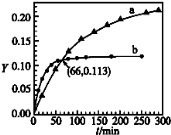
A.b代表0℃下CH3COCH3的Y﹣t曲线
B.反应进行到20min末,CH3COCH3的
C.升高温度可缩短反应达平衡的时间并能提高平衡转化率
D.从Y=0到Y=0.113,CH3COCH2COH(CH3)2的
难度: 中等查看答案及解析
-
在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的是( )
A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl﹣、CH3COO-
B.pH值为1的溶液:Cu2+、Na+、Mg2+、NO3﹣
C.水电离出来的c(H+)=10﹣12mol/L的溶液:K+、HCO3﹣、Br﹣、Ba2+
D.所含溶质为Na2CO3的溶液:K+、Ca2+、NO3﹣、Al3+
难度: 困难查看答案及解析
-
对于可逆反应:2A(g)+B(g)⇌2C(g)△H<0,下列各图中正确的是( )
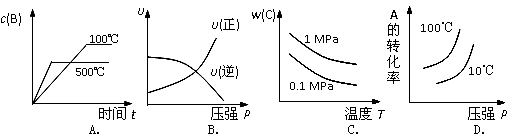
难度: 中等查看答案及解析
-
在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH
CH3COO-+H+对于该平衡,下列叙述正确的是()
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
难度: 中等查看答案及解析
-
密闭容器中,反应xA(g) + yB(g)
zC(g)达平衡时,A的浓度为0.5mol/L, 若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。下列判断正确的是( )
A. x+y < z B.平衡向正反应方向移动
C. B的转化率升高 D.C的体积分数下降
难度: 中等查看答案及解析