-
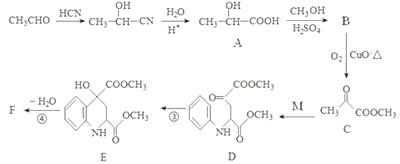
药物F具有抗肿瘤、降血糖、降血压等多种生物活性,其合成路线如下:
已知:M的结构简式为:
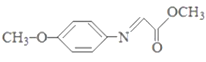 。
。请回答下列问题:
(1)A的化学名称是______________________。
(2)C中官能团的名称是_________________________。
(3)写出F的结构简式____________________________。
(4)已知A在一定条件下能生成可降解的聚酯,请写出该反应化学方程式:_________________。
(5)满足下列条件的M的同分异构体有_____ 种(不含立体异构)。
①能够发生银镜反应。
②含有硝基(-NO2),且硝基直接连在苯环上。
③含有苯环且苯环上只有两个取代基。
其中核磁共振氢谱为四组峰且峰面积之比为6:2:2:1的结构简式为______________( 写出一种即可)。
(6)写出用乙醛为原料制备高分子化合物聚丙烯腈的合成路线(无机试剂任选):_____________。
难度: 中等查看答案及解析
-
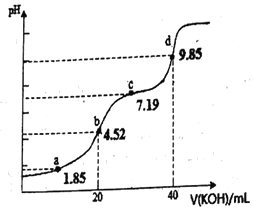
用钒钛磁铁为原料冶炼铁,产生一种固体废料,主要成分如下表。
物质
TiO2
MgO
SiO2
CaO
Al2O3
质量百分含量/%
51.00
12.52
5.39
4.00
19.34
通过下列工艺流程可以实现元素Ti、Al、 Si的回收利用,并得到纳米二氧化钛和分子筛。
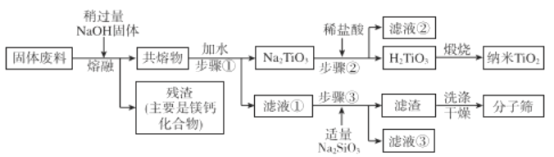
请回答下列问题:
(1)步骤①②③中进行分离操作的名称是_____________________。
(2)下列固体废料的成分中,不属于碱性氧化物的是___________________(填字母序号)。
a.TiO2 b.MgO c.SiO2 d.CaO
(3)熔融温度和钛的提取率关系如下图,适宜温度为500℃,理由__________________。

(4)滤液①中溶质的成分是_______________________。
(5)步骤②中发生反应的离子方程式是___________________________。
(6)将步骤③中制取分子筛的化学方程式补充完整:_______
□____+6Na2SiO3+8H2O=Na8Al6Si6O24(OH)2·2H2O+□
根据成分表中数据,计算10kg固体废料,理论上应再加入Na2SiO3物质的量的计算式是n(Na2SiO3)=______mol (摩尔质量/g/mol:SiO2 60 Al2O3 102)。
难度: 中等查看答案及解析
-
黄铁矿石的主要成分为FeS2和少量FeS(假设其它杂质中不含铁、硫元素,且高温下不发生化学变化),它是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为4FeS2+11O2=2Fe2O3+8SO2,4FeS+7O2=2Fe2O3+4SO2
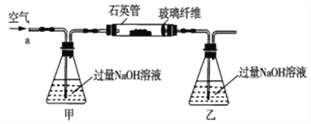
(实验一)测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:

(1)鼓入空气的作用是_____________________。
(2)反应结束后,给乙瓶溶液中加入足量H2O2溶液的目的是___________(用化学方 程式表示)。H2O2可以看成是一种很弱的酸,写出其主要的电离方程式为____________________。
(3)该黄铁砂石中硫元素的质量分数为____________________(列出 表达式即可)。
(实验二)测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤 ③将过滤液稀释至250mL
④取25.00 mL稀释液,用0.100 mol·L-1的酸性KMnO4溶液滴定
(4)步骤②中,若用铁粉作还原剂,则所测得的铁元素的含量__________(填“偏大”“ 偏小” 或“无影响”)。
(5)请写出步骤②中洗涤的方法____________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
第一次
第二次
第三次
第四次
消耗KMnO4溶液体积/ml
25.00
25.03
20.00
24.97
根据所给数据,计算该稀释液中Fe2+的物质的量浓度c(Fe2+)=__________。
难度: 中等查看答案及解析
-
“低碳资源”正成为科学家研究的主要课題,为了减少空气中的温室气体,并且充分利用二氧化碳资源,科学家们设想了一系列捕捉和封存二氧化碳的方法。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) △H=-76.0kJ·mol-1
①己知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4kJ·mol-1
则反应:3FeO(s)+H2O(g)= Fe3O4(s)+ H2(g)的△H=______________。
(2)用氨水捕集烟气中的CO2生成铵盐是减少CO2排放的可行措施之一。
①分別用不同pH的吸收剤吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如下图所示,若烟气中CO2的含量(体积分数)为12%,烟气通入氨水的流量为0.052 m3·h-1(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为_________ (精确到0.01)。
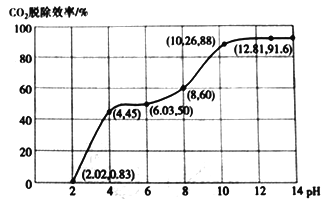
②通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是_________________ 。
(3)一定条件下,Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如下图所示。
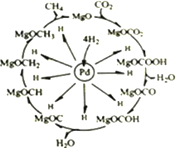
①该反应的化学方程式为___________________;反应过程中碳元素的化合价为-2价的中间体是__________________________。
②向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1、H2:0.8 mol·L-1、CH4:0.8 mol·L-1、H2O:1.6 mol·L-1,CO2的平衡转化率为___________________。
③己知该反应正反应放热,现有两个相同的恒容绝热(与外界无热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1molCO2和4molH2,在Ⅱ中充入1molCH4和2molH2O(g),300℃下开始反应。达到平衡时,下列说法正确的是_____________(填字母)。
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅱ中CH4的物质的量分数相同
C.容器Ⅰ中CO2的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO2的转化率与容器Ⅱ中CH4的转化率之和小于1
难度: 中等查看答案及解析
-
碳是地球上组成生命的最基本的元素之一。根据要求回答下列问题:
(1)碳原子的价电子排布图:_________,核外有_________种不同运动状态的电子。
(2)碳可以形成多种有机化合物,下图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。

①嘌呤中所有元素的电负性由大到小的顺序__________。
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因_____________。
③吡啶结构中N 原子的杂化方式___________。
④分子中的大π键可以用符号
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
)。该嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为__________。
(3)碳可形成CO、CO2、H2CO3等多种无机化合物。
①在反应CO 转化成CO2 的过程中,下列说法正确的是______。
A.每个分子中孤对电子数不变 B.分子极性变化
C.原子间成键方式改变 D.分子的熔沸点变大
②干冰和冰是两种常见的分子晶体,晶体中的空间利用率: 干冰___冰。(填“>”、 “<”或“=”)
③H2CO3与H3PO4 均有1个非羟基氧,H3PO4为中强酸,H2CO3为弱酸的原因______。
(4)在2017 年,中外科学家团队共同合成了碳的一种新型同素异形体: T- 碳。T- 碳的结构是: 将立方金刚石中的每个碳原子用一个由4 个碳原子组成的正四面体结构单元取代,形成碳的一种新型三维立方晶体结构,如下图。已知T- 碳晶胞参数为a pm,阿伏伽德罗常数为NA,则T- 碳的密度的表达式为______g/cm3。
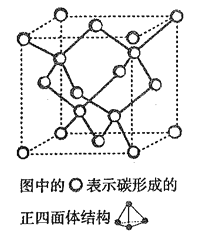
难度: 困难查看答案及解析