-
“千锤万凿出深山,烈火焚烧若等闲。粉身碎骨浑不怕,只留清白在人间。”明代诗人于谦的《石灰吟》中对“CaCO3→CaO”的转化进行拟人化描述。下列说法正确的是
A. 上述转化属于分解反应 B. 上述转化过程放出大量热
C. 生成的CaO可作氯气的干燥剂 D. CaCO3是水泥的主要成分之一
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 1L0.1mol/LNaC1O溶液中,C1O-的数目为0.1NA
B. 常温常压下,11.2LCH4含有的共用电子对数目为2NA
C. 16gO2与O3混合气体中,氧原子的数目为1.5NA
D. 1molFe与足量Cl2完全反应后,转移的电子数目为3NA
难度: 中等查看答案及解析
-
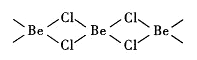
“分子马达”的关键组件三蝶烯的结构如右图所示。下列说法正确的是

A. 三蝶烯是苯的同系物
B. 三蝶烯能发生取代反应
C. 三蝶烯的一氯代物有6种
D. 三蝶烯分子中所有原子可能在同一平面上
难度: 中等查看答案及解析
-
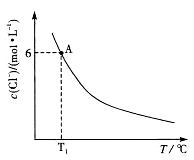
下列措施中,能使饱和食盐水中c(OH-)减小的是
A. 加热 B. 投入金属钠 C. 加入NaHSO4固体 D. 以惰性电极电解
难度: 中等查看答案及解析
-
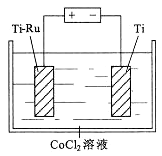
下列实验能达到实验目的的是
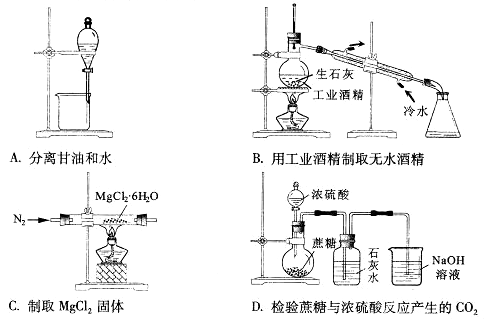
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
二甲醚(CH3OCH3)--空气燃料电池的工作原理如右图所示。电池工作时,下列说法正确的是

A. a极区溶液的pH变大
B. b极有H2O生成
C. a极反应式:CH3OCH3+3O2--12e-=2CO2↑+6H+
D. 每消耗11.2LO2(标准状况),有2molH+向左侧移动
难度: 中等查看答案及解析
-
X、Y、Z、W为原子序数递增的4种短周期元素,其中Y、Z为金属元素。X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如右下图所示反应关系吸图中“—”相连的两种物质能发生反应)。下列判断一定正确的是

A. X是元素周期表中非金属性最强的元素 B. Z位于元素周期表第3周期IA族
C. 4种原子中,Y原子半径最大 D. W的最高化合价为+7
难度: 困难查看答案及解析