-
将铜锌合金溶解后与足量KI溶液反应(Zn2+不与I-反应),生成的I2用Na2S2O3标准溶液滴定,根据消耗的Na2S2O3溶液体积可测算合金中铜的含量。实验过程如下图所示:

回答下列问题:
(1)H2O2的电子式为_________;“溶解”后铜元素的主要存在形式是______(填离子符号)。
(2)“煮沸”的目的是除去过量的H2O2。298K时,液态过氧化氢分解,每生成0.01molO2放出热量1.96kJ,该反应的热化学方程式为_______________。
(3)用缓冲溶液“调PH”是为了避免溶液的酸性太强,否则“滴定”时发生反应:
S2O32-+2H+=S↓+SO2↑+H2O
① 该缓冲溶液是浓度均为0.10mol/L的CH3COOH和CH3COONH4的混合溶液。25℃时,溶液中各种离子浓度由大到小的顺序为_________。
[已知:25℃时,Ka(CH3COOH)=Kb(NH3·H2O)=1.8×10-5]
② 若100 mL Na2S2O3溶液发生上述反应时,20s后生成的SO2比S多3.2g,则v(Na2S2O3)=_____mol/(L·s)(忽略溶液体积变化的影响)。
(4)“沉淀”步骤中有CuI沉淀产生,反应的离子方程式为_____________。
(5)“转化”步骤中,CuI转化为CuSCN,CuSCN吸附I2的倾向比CuI更小,使“滴定”误差减小。沉淀完全转化后,溶液中c(SCN -):c(I-)≥_______________。
[已知:Ksp(CuI)=1.1×10-12;Ksp(CuSCN)=4.4×10-15]
(6)下列情况可能造成测得的铜含量偏高的是______(填标号)。
A. 铜锌合金中含少量铁
B. “沉淀”时,I2与I-结合生成I3- :I2+I-=I3-
C. “转化”后的溶液在空气中放置太久,没有及时滴定
D. “滴定”过程中,往锥形瓶内加入少量蒸馏水
-
将铜锌合金溶解后与足量KI溶液反应(Zn2+不与I-反应),生成的I2用Na2S2O3标准溶液滴定,根据消耗的Na2S2O3溶液体积可测算合金中铜的含量。实验过程如下图所示:

回答下列问题:
(1)H2O2的电子式为_________;“溶解”后铜元素的主要存在形式是______(填离子符号)。
(2)“煮沸”的目的是除去过量的H2O2。298K时,液态过氧化氢分解,每生成0.01molO2放出热量1.96kJ,该反应的热化学方程式为_______________。
(3)用缓冲溶液“调PH”是为了避免溶液的酸性太强,否则“滴定”时发生反应:
S2O32-+2H+=S↓+SO2↑+H2O
① 该缓冲溶液是浓度均为0.10mol/L的CH3COOH和CH3COONH4的混合溶液。25℃时,溶液中各种离子浓度由大到小的顺序为_________。
[已知:25℃时,Ka(CH3COOH)=Kb(NH3·H2O)=1.8×10-5]
② 若100 mL Na2S2O3溶液发生上述反应时,20s后生成的SO2比S多3.2g,则v(Na2S2O3)=_____mol/(L·s)(忽略溶液体积变化的影响)。
(4)“沉淀”步骤中有CuI沉淀产生,反应的离子方程式为_____________。
(5)“转化”步骤中,CuI转化为CuSCN,CuSCN吸附I2的倾向比CuI更小,使“滴定”误差减小。沉淀完全转化后,溶液中c(SCN -):c(I-)≥_______________。
[已知:Ksp(CuI)=1.1×10-12;Ksp(CuSCN)=4.4×10-15]
(6)下列情况可能造成测得的铜含量偏高的是______(填标号)。
A. 铜锌合金中含少量铁
B. “沉淀”时,I2与I-结合生成I3- :I2+I-=I3-
C. “转化”后的溶液在空气中放置太久,没有及时滴定
D. “滴定”过程中,往锥形瓶内加入少量蒸馏水
-
将锌铜合金溶解后与足量KI溶液反应(Zn2+不与I-反应),生成的I2用Na2S2O3标准溶液滴定,根据消耗的Na2S2O3溶液体积可测算合金中铜的含量。实验过程如下图所示:
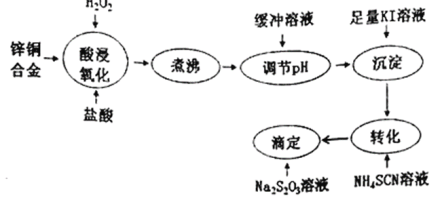
回答下列问题:
(1)H2O2的电子式为___________;“酸浸氧化”后铜元素的主要存在形式是___________(填离子符号)。
(2)“煮沸”的目的是____________________________________________。
(3)用缓冲溶液“调pH”是为了避免溶液的酸性太强,否则“滴定”时发生反应的离子方程式:_______________________________________________________;
①若100mLNa2S2O3溶液发生上述反应时,20s后生成的SO2比S多6.4g,则v(Na2S2O3)=___________mol/(L·s)(忽略溶液体积变化的影响)。
②该缓冲溶液是浓度均为0.10mol/L的CH3COOH和 CH3 COONH4的混合溶液。25℃时,溶液中各种离子浓度由大到小的顺序为_________________________________。(已知:25℃时,Ka(CH3COOH)=Kb(NH3·H2O)=1.8×10-5)
(4)“沉淀”步骤中有CuI沉淀产生,反应的离子方程式为______________________。
(5)“转化”步骤中,CuI转化为 CuSCN, CuSCN吸附I2的倾向比CuI更小,使“滴定”误差减小。沉淀完全转化后,溶液中c(SCN-):c(I-)≥___________。(已知:Ksp(CuI)=1.0×10-12;Ksp( CuSCN)=4.4×10-15)
(6)下列情况可能造成测得的铜含量偏高的是___________(填标号)。
A.铜锌合金中含少量铁
B.“沉淀”时,I2与I-结合生成I3-:I2+ I-= I3-
C.“转化后的溶液在空气中放置太久,没有及时滴定
D.“滴定”过程中,往锥形瓶内加入少量蒸馏水
-
将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是
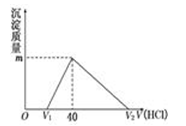
A.原合金质量为0.92 g
B.标准状况下产生氢气896 mL
C.图中m值为1.56 g
D.图中V2为60 mL
-
将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1 mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示。

则下列选项正确的是
A.原合金质量为0.92 g
B.标准状况下产生氢气896 mL
C.图中m值为1.56 g
D.图中V2为60 mL
-
将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是
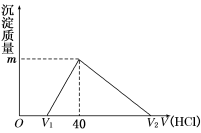
A.原合金质量为0.92 g B.标准状况下产生氢气896 mL
C.图中V2为60 mL D.图中m值为1.56 g
-
将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是
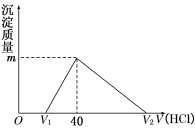
A.原合金质量为0.92 g B.标准状况下产生氢气896 mL
C.图中V2为60 mL D.图中m值为1.56 g
-
25 ml 加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol/L的Na2S2O3溶液作标准溶液滴定反应生成的碘,已知反应式为:
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
反应完成时,共用去Na2S2O3 20.0 ml。则该漂白粉中Ca(ClO)2的质量分数为:________
14、(8分)向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):

2)整个过程中的还原剂是。
3)把KI换成KBr,则CCl4层变为__________色:继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是。
4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若用Kl与Cl2反应制KIO3,至少需要消耗Cl2________L(标准状况,保留2位小数)。
-
将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如下图所示,则下列选项正确的是
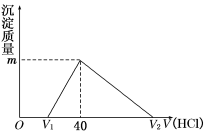
A.图中m值为1.56 g
B.标准状况下产生氢气896 mL
C.图中V2为60 mL
D.原合金质量为0.92 g
-
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1 mol/L的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
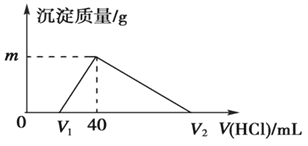
A. 原合金质量为 0.92 g
B. 产生氧气的体积为896 mL(标准状况下)
C. 图中m的值为1.56
D. 图中V2的值为60









