-
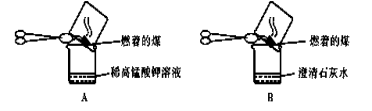
某溶液中含有HCO3-、SO32-、Cl-和Na+,若向其中通入足量的Cl2,溶液中上述四种离子的
浓度基本保持不变的是
A.HCO3- B.SO32- C.Cl- D.Na+
难度: 中等查看答案及解析
-
下列实验过程中,始终无明显现象的是
A.HCl通入Fe(NO3)2溶液中 B.CO2通入Ca(NO3)2溶液中
C.Cl2通入Na2SiO3溶液中 D.NH3通入Ca(HCO3)2溶液中
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列叙述正确的是
A.常温常压下,4.6g NO2或N2O4气体中所含原子总数均为0.3NA
B.标准状况下,22.4 mL Br2所含的分子数为0.001NA
C.标准状况下,22.4L的Cl2与1molFe充分反应,转移的电子数为3NA
D.100 mL0.1mol•L-1的H2SO3溶液中,H+总数为0.02 NA
难度: 中等查看答案及解析
-
下列有关实验操作、现象和解释或结论都正确的是
选项
操作
现象
解释或结论
A
过量的Fe粉中加入稀HNO3,充分反应后,滴加KSCN溶液
溶液呈红色
稀HNO3将Fe氧化为Fe3+
B
Al箔插入稀HNO3中
无现象
Al箔表面被稀HNO3氧化,
形成致密的氧化膜
C
向某溶液中滴加稀NaOH溶液,将湿润
红色石蕊试纸置于试管口
试纸未变蓝
不能确定该溶液中是否含
有NH4+
D
向紫色石蕊试液中通入SO2
溶液褪色
SO2有漂白性
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.NO2通入AgNO3溶液中:3NO2+H2O=2NO3-+NO+2H+
B.过量的SO2通入NaOH溶液中:SO2+2OH-=SO32-+H2O
C.过量NaOH滴入NH4HCO3稀溶液中:NH4++OH-=NH3·H2O
D.铜片加入稀HNO3中:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O
难度: 中等查看答案及解析
-
常温,下列气体不能共存且发生的反应属于非氧化还原的是
A.NO和O2 B.SO2和H2S
C.NH3和HCl D.Cl2和SO2
难度: 中等查看答案及解析
-
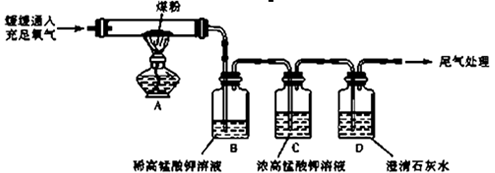
(NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4
N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,将反应后的混合气体先通过置于冰水浴的U型管,再通入足量的BaCl2溶液,结果为
A.产生BaSO4和BaSO3沉淀 B.无沉淀产生
C.产生BaSO4沉淀 D.产生BaSO3沉淀
难度: 中等查看答案及解析
-
某同学对一瓶Na2SO3固体样品进行如下实验:取出少量,加水完全溶解,滴入Ba(NO3)2
溶液,产生白色沉淀,再加入足量稀硝酸,仍有白色沉淀剩余。下述叙述正确的是
A.无法确定样品中钠、硫元素的质量比
B.Na2SO3已被氧化
C.加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4
D.加入稀硝酸后的沉淀一定是BaSO4
难度: 中等查看答案及解析
-
气体甲(中学常见)通入溶液乙中,随着甲的通入,溶液乙的颜色逐渐褪去,加热褪色后的溶液不再恢复原来的颜色。下列说法正确的是
A.气体甲一定不是SO2 B.气体甲一定是Cl2
C.气体甲一定不是发生了化合反应 D.气体甲一定被溶液乙氧化
难度: 中等查看答案及解析
-
下列所用的酸在反应中同时表现酸性和氧化性的是
A.用浓盐酸与KMnO4反应制取Cl2
B.向蔗糖中加入浓H2SO4,固体变黑膨胀
C.用稀硫酸与CuO反应制取胆
D.用浓硝酸除去铝表面的铜镀层
难度: 中等查看答案及解析
-
保存下列试剂时,不需使用棕色试剂瓶的是
A.NaHCO3 B.浓硝酸 C.氯水 D.AgBr
难度: 中等查看答案及解析
-
下列实验装置中能达到实验目的的是
A.以NH4Cl为原料,装置①可用于实验室制备少量NH3
B.装置②装满水后由b口进气可收集H2、NO等气体
C.装置③可用于制取、收集NO2
D.装置④可用于除去Cl2中的HCl



① ② ③ ④
难度: 中等查看答案及解析
-
下列反应中转移电子的物质的量不等于2 mol的是
A.1 mol Al与含1mol H2SO4的稀硫酸溶液反应
B.1mol Cu与含4mol HNO3的稀硝酸溶液反应
C.1 mol MnO2与含2 mol H2O2的双氧水反应
D.1 mol Cu与含2 mol H2SO4的浓硫酸共热
难度: 中等查看答案及解析
-
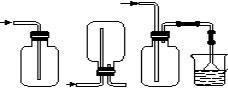
无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100 mL甲气体经过下图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为
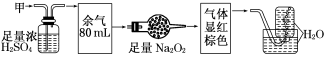
A.NH3、NO2、N2 (体积比5∶16∶4)
B.NH3、NO、CO2 (体积比5∶8∶12)
C.NH3、NO2、CO2 (体积比3∶8∶4)
D.NO、CO2、N2 (体积比8∶12∶5)
难度: 困难查看答案及解析
-
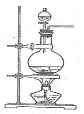
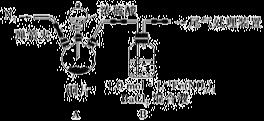
已知氨气可以与灼热的氧化铜反应得到氮气和金属铜,用下图中的装置可以实现该反应。
实验时C中粉末逐渐变为红色,D中出现无色液体。下列有关说法正确的是
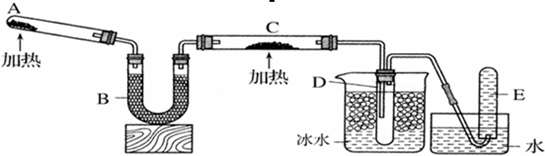
A.反应中氧化剂和还原剂的物质的量之比为2∶3
B.装置B中加入的物质可以是碱石灰或无水氯化钙
C.装置D中液体可以使干燥的红色石蕊试纸变蓝
D.为防止装置D中发生倒吸,可以改用向下排空气法收集氮气
难度: 困难查看答案及解析
-
已知SO32-的还原性大于I-的还原性,某无色溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液组成的判断正确的是
①肯定不含I-;②肯定不含Cu2+;③肯定含有SO32-;④可能含有I-
A.①③ B.①②③ C.③④ D.②③④
难度: 中等查看答案及解析
-
某固体物质和某溶液在一定条件下反应,产生气体的相对分子质量(或平均相对分子质量)为45,则发生反应的物质不可能是
A.Zn和浓H2SO4 B.C和浓HNO3 C.Na2O2和NH4Cl浓溶液 D.Cu和浓HNO3
难度: 中等查看答案及解析
-
将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,共产生NO气体4.48 L(标准状况),向所得溶液中加入物质的量浓度为3 mol·L-1的NaOH溶液至沉淀完全。则下列有关叙述中不正确的是
A.开始加入合金的物质的量之和为0.3mol
B.反应中被还原和未被还原的硝酸物质的量之比为3∶1
C.沉淀完全时消耗NaOH溶液的体积为200mL
D.生成沉淀的质量比原合金的质量增加10.2g
难度: 中等查看答案及解析