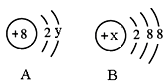-
下列有关概念的叙述正确是
A.同素异形体间在一定条件下可以相互转换,转换过程中发生的是物理变化
B.各同位素原子核中质子数一定相同,中子数一定不同,质量数可能相同
C.CuSO4与CuSO4·5H2O混合后得到的是混合物;水和冰混合后得到的是纯净物
D.氨水可以导电,但氨水是非电解质;氯化银溶液导电性差,但氯化银是强电解质
难度: 中等查看答案及解析
-
下列有关金属元素及其化合物说法不正确的是
A.铁和氯气反应生成三价铁,和盐酸反应生成亚铁离子
B.铜在潮湿的空气中易生锈呈绿色,锈的主要成分是碱式碳酸铜
C.过氧化钠和氧化钠均可以与水、二氧化碳反应,但生成的产物不完全相同
D.等质量的铝分别与足量的酸和碱溶液反应,生成气体的体积一定相同
难度: 中等查看答案及解析
-
下列说法正确的是
A.离子键只存在于离子化合物中,共价键只存在于共价化合物中
B.热稳定性:NH3>PH3>AsH3;酸性:HClO4>H2SO4>H3PO3
C.BF3和CS2分子中所有原子的最外层都是8电子稳定结构
D.钠离子的半径大于镁离子的半径,氯离子的还原性强于硫离子的还原性
难度: 中等查看答案及解析
-
下列关于氧化还原反应的说法正确是
A.水在化学反应中既可以作氧化剂,又可以作还原剂
B.1molCl2与足量Fe反应,转移的电子数为3NA
C.发生化学反应时失去电子数越多的金属原子,还原能力越强
D.若A2+2D- =2A-+D2,则氧化性:D2>A2
难度: 中等查看答案及解析
-
实验室中制取下列物质的方案均合理的是
A.铜和浓硫酸反应,亚硫酸钠和浓硫酸反应均可以制取二氧化硫
B.铜和浓硝酸反应,碳和浓硝酸反应均可以制取二氧化氮
C.向氯化铝溶液中加入过量氨水,或加入过量的氢氧化钠溶液均可制取氢氧化铝
D.向次氯酸钙溶液中通入适量二氧化碳,或通入适量二氧化硫均可制取次氯酸
难度: 中等查看答案及解析
-
下列有关定量判断正确的是
A.18gH218O分子中含有的10NA个质子
B.将3mol NO2完全溶于水,生成NO气体,气体的物质的量变为2mol
C.将1.5molCO2气体通入到1L 1mol/L的NaOH溶液中,生成1mol碳酸钠
D.2Cu2S+2H2SO4+5O2=4CuSO4+2H2O反应中,当1mol O2发生反应时,还原剂所失电子的物质的量
为4mol
难度: 中等查看答案及解析
-
将镉(Cd)浸在氯化钴(CoCl2)溶液中,发生反应的离子方程式为:Co2+(aq)+Cd(s)=Co(s)+Cd2+(aq)(aq表示溶液),如将该反应设计为如右图的原电池,则下列说法一定错误的是
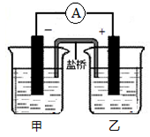
A.Cd作负极,Co作正极
B.原电池工作时,电子从负极沿导线流向正极
C.根据阴阳相吸原理,盐桥中的阳离子向负极(甲池)移动
D.甲池中盛放的是CdCl2溶液,乙池中盛放的是CoCl2溶液
难度: 中等查看答案及解析