-
高锰酸钾和二氧化锰是中学化学常用的化学试剂。根据下面相关的信息回答下列问题:
(1)已知:

②

锰有多种化合价,如+7、十6、+4、+2价等,在中性溶液里高锰酸钾的还原产物为________(填化学式)。
(2)查阅相关资料:发生如下反应(反应未配平):

已知在高锰酸钾固体表面滴加浓盐酸,发生的半反应为
如果在盛有氯化锰溶液的试管中加入适量XeO3,振荡试管,可能观察到的现象是________。
(3)已知草酸(H2C2O4)为二元弱酸,取少量草酸晶体溶于酸性高锰酸钾溶液,溶液的紫色褪去。
写出该反应的离子方程式________。
(4)MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为________。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为________,当蓄电池中有4mol H+被消耗时,则电路中通过的电子的物质的量为________,MnO2的理论产量为________g。

难度: 困难查看答案及解析
-
氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位。工业制硝酸的主要反应之一是
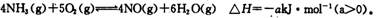
(1)如果将4mol NH3和5mol O2放入容器中,达到平衡时放出热量0.8akJ,则平衡时NH3的转化率为________。
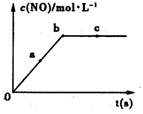
(2)在一定条件下,容积固定的密闭容器中进行上述反应,NO的浓度与时间关系如图所示,则NO的a、b、c三点的反应速率v(a正)、v(b逆)、v(c正)的大小关系是________。
(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
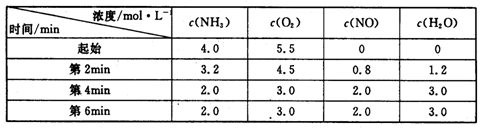
①第2min到第4mim,反应速率v(O2)=________;
②第2min时改变了条件,改变的条件可能是________(从所给选项中选择);
A.降低温度 B.增加了生成物 C.减小压强 D.使用了高效催化剂
③在与第4min相同的温度下,若起始向容器中加入NH3、O2、NO和H2O(g)的浓度都为2moI/L,则该反应________(填“正反应方向进行”、“逆反应方向进行”、“不移动”)。
(4)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。尿素(H2NCONH2)是一种非常重要的高氮化肥,在温度70—95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2,尿素与NO、NO2三者等物质的量反应的化学方程式为。
(5)目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
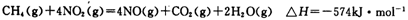
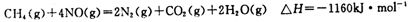
则1mol甲烷直接将NO2还原为N2的烩变为____________。
难度: 极难查看答案及解析
-
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。请回答下列问题:
(1)青铜的主要组成元素是铜元素和锡元素,请写出锡原子的价电子排布式________。
(2)向硫酸铜溶液里滴加氨水至过量,再加入乙醇,析出晶体,此物质中含有的化学键类型为________,SO2—4的立体构型是________,其中S原子的杂化轨道类型是________。
(3)N、O、F三种元素的电负性由大到小的顺序为________,Cu2O的熔点高于Cu2S,请解释原因:________。
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的化学方应程式为。
(5)用晶体的x射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.00g.cm-3,据此计算阿伏加德罗常数为________[列式并计算,结果用科学记数法表示,保留两位小数,己知Ar(Cu)=63.6]。
难度: 中等查看答案及解析
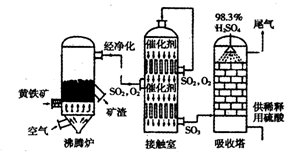
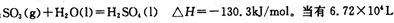 (已折算为标况下)SO3气体与H2O化合时放出的热量为________(保留两位有效数字)。
(已折算为标况下)SO3气体与H2O化合时放出的热量为________(保留两位有效数字)。

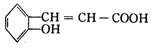 有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式________。
有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式________。