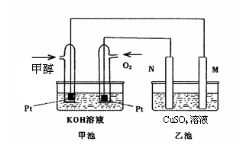
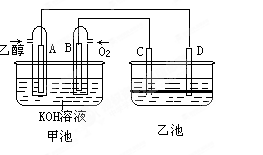
-
下列说法正确的是
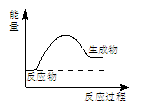
A.上图所示的是一个放热反应
B.加入催化剂v(正)增大、v(逆)减小
C.燃烧热是生成1molH2O放出的热量
D.只有活化分子才能发生有效碰撞
难度: 简单查看答案及解析
-
对于反应A(g)+3B(g)
2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
A.v(A)=0.2mol/(L•s) B.v(B)=0.2 mol/(L•s)
C.v(B)=0.3mol/(L•s) D.v(C)=0.2mol/(L•s)
难度: 中等查看答案及解析
-
一定量的稀盐酸跟过量锌粉反应时,为了减缓反应速率又不影响生成H2的总量,可采取
的措施是
A.加入少量稀NaOH溶液 B.加入少量CH3COONa固体
C.加入少量NH4HSO4固体 D.加入少量Na2CO3浓溶液
难度: 中等查看答案及解析
-
下图为一原电池的结构示意图,下列说法中,错误的是
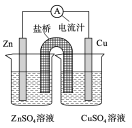
A.Cu电极为正电极
B.原电池工作时,电子从Zn电极流出
C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu
D.盐桥(琼脂-饱和KCl溶液)中的K+移向ZnSO4溶液
难度: 中等查看答案及解析
-
下列表述中,合理的是
A.将水加热,Kw增大,pH不变
B.把FeCl3的水溶液加热蒸干可得到FeCl3固体
C.用25 mL碱式滴定管量取20.00mL高锰酸钾溶液
D.用惰性电极电解足量的AgNO3溶液时,当有0.2 mole-转移时会析出21.6g银
难度: 中等查看答案及解析
-
某小组为研究电化学原理,设计如图装置。下列叙述错误的是
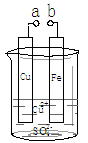
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C.a和b分别连接足够电压的直流电源正、负极时,Cu2+向铜电极移动
D.无论a和b是否用导线连接,铁片均溶解,溶液从蓝色逐渐变成浅绿色
难度: 中等查看答案及解析
-
若醋酸用HAc表示,则在0.1mol·L-1 NaAc溶液中,下列离子浓度关系正确的是
A.c(Na+)= c(Ac—)+c(HAc)
B.c(Na+)+c(OH—)= c(Ac— )+c(H+)
C.c(Na+)>c(OH—) > c(Ac—) > c(H+)
D.c(Na+)> c(Ac—)> c(H+)> c(OH—)
难度: 中等查看答案及解析
-
在一定温度下的定容密闭容器中,当下列条件不再改变时,表明反应:A(s)+2B(g)
C(g)+D(g)已达到平衡状态的现象是
A.混合气体的压强
B.混合气体的密度
C.气体的总物质的量
D.单位时间内生成n mol C的同时消耗2n molB
难度: 中等查看答案及解析
-
下列物质的水溶液中,除了水分子外,不存在其他分子的是:
A、HCl B、NH4NO3 C、Na2S D、HClO
难度: 中等查看答案及解析
-
某反应:A
B + C 在室温下不能自发进行,在高温下能自发进行,对该反应过程△H、△S的判断正确的是
A、△H>0、△S>0 B、△H>0、△S<0
C、△H<0、△S>0 D、△H<0、△S<0
难度: 简单查看答案及解析
-
某学生欲完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的是
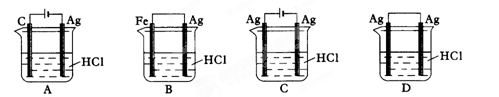
难度: 中等查看答案及解析
-
一定温度下,把2. 0体积的N2和6. 0体积的H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,容器中发生如下反应:N2+3H2
2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是
A.1.0体积的N2和3.0体积的H2
B.2.0体积的N2、6.0体积的H2和4.0体积的NH3
C.4.0体积的NH3和1.0体积的H2
D.2.0体积的NH3
难度: 中等查看答案及解析
-
某同学在实验报告中记录下列数据,其中正确的是
A.用25 mL量筒量取12.36 mL盐酸
B.用托盘天平称取8.75克食盐
C.用电子天平称取1.2355克无水碳酸钠
D.用广泛pH试纸测得某溶液pH为3.5
难度: 简单查看答案及解析
-
下列关于热化学反应的描述中正确的是
A.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
B.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57. 3)kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
难度: 中等查看答案及解析
-
某溶液中由水电离产生的C(H+)=1.0×10-10mol/L,则下列各组离子在该溶液中肯定能大量共存的是: A、K+、Na+、HCO3—、Cl— B、Na+、K+、NO3—、Cl-
C、K+、Na+、S2-、NO3— D、Mg2+、Na+、SO32—、CO32—
难度: 中等查看答案及解析
-
下列叙述正确的是
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.25℃时,在纯水中加入强碱溶液不会影响水的离子积常数
C.pH=3的醋酸溶液加水稀释10倍后pH=4
D.pH=3和pH=5的盐酸各10mL混合所得溶液的pH=4
难度: 中等查看答案及解析
-
化学用语是学习化学的工具和基础。下列有关化学用语的使用正确的是
A.用食醋除去水壶内的水垢:CaCO3+2H+ = Ca2++CO2↑+H2O
B.纯碱溶液呈碱性的原因是:CO32—+2H2O
H2CO3+2OH—
C.钢铁发生吸氧腐蚀的正极反应式:O 2+ 4e- +2H2O =4OH—
D.表示氢硫酸呈酸性的方程式为:H2S
2H++S2-
难度: 中等查看答案及解析
-
下图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为Pt电极。接通电源后,发现d点显红色。下列有关说法正确的是
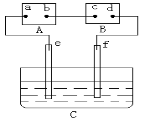
A.电源A上的a极是正极
B.d极上的电极反应方程式为2Cl--2e-=Cl2↑
C.e、f极上产生的气体体积比为2:1
D.C中溶液的pH增大
难度: 中等查看答案及解析
-
高温下,某反应达平衡,平衡常数K=
。恒容时,温度升高,H2 浓度减小。下列说法正确的是
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO + H2O
CO2 + H2
难度: 中等查看答案及解析
-
下列措施或事实能用勒沙特列原理解释的是
A、在合成氨(正反应是放热)的反应中,升温有利于氨的合成
B、钢铁在潮湿的空气中生锈
C、H2、I2、HI平衡混合气加压后颜色变深
D、新制的氯水在光照下颜色变浅
难度: 中等查看答案及解析
-
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是
A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+
D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+
难度: 中等查看答案及解析
-
向足量H2SO4溶液中加入100mL 0.4 mol·L—1 Ba(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4 mol·L—1 HCl溶液时,放出的热量为2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为
A.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-2.92kJ·mol—1
B.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-0.72kJ·mol—1
C.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-73kJ·mol—1
D.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-18kJ·mol—1
难度: 中等查看答案及解析
-
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
 下列叙述错误的是:
下列叙述错误的是:A.放电时正极附近溶液的碱性增强
B.放电时每转移3 mol电子,正极有1mol K2FeO4被还原
C.充电时锌极与外电源负极相连
D.充电时阳极反应为:Fe(OH)3— 3e-+ H2O FeO42-+5H+
难度: 困难查看答案及解析
-
下列物质中能抑制水的电离且使溶液呈现出酸性的是:
A. Na2CO3 B. Al2(SO4)3 C. K2SO4 D. H2SO4
难度: 简单查看答案及解析
-
根据下列有关图象,说法正确的是

A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0
B.由图Ⅱ知,反应在t6时,NH3体积分数最大
C.由图Ⅱ知,t3时采取降低反应温度的措施
D.图Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出51.6kJ的热量
难度: 极难查看答案及解析
-
下列水溶液一定呈中性的是
A.pH=7的溶液
B.c(H+)=1.0×10-7mol·L-1的溶液
C.c(H+) =c(OH-)
D.pH=3的酸与pH=11的碱等体积混合后的溶液
难度: 中等查看答案及解析
-
物质的量浓度相同的三种盐 NaX、NaY和NaZ的溶液,若它们的pH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的排列顺序是
A.HX、HZ、HY B.HZ、HY、HX
C.HX、HY、HZ D.HY、HZ、HX
难度: 简单查看答案及解析
-
常温下c(H+)最小的是下列各项中的
A. pH=0的溶液. B. 0.04 mol·L-1 H2SO4
C. 0.5 mol·L-1 HCl D. 0.05 mol·L-1HNO3
难度: 简单查看答案及解析
-
向含下列离子的溶液中分别加入NaOH固体(溶液体积不变),能引起离子浓度减小的是
A. Cl- B. OH- C. AlO2- D. HCO3-
难度: 简单查看答案及解析