-
SO2是重要的化工原料,但其造成的环境问题也引起了人们的关注。开发寻找SO2的合理替代品是目前化工行业的新动态。
(1)SO2可以与水反应,反应的化学方程式为____________________________________。SO2是大气的主要污染物,是造成__________________的根源。
(2)工业上常用黄铁矿(FeS2)制备SO2,黄铁矿中S的化合价为____________。黄铁矿煅烧后生成1.6gFe2O3,转移的电子数为________。
(3)工业上使用碱液吸收SO2,使排放的尾气达到合格标准:
①将标准状况下11.2LSO2通入到2L0.5mol·L-1的氨水中,所得溶液中溶质是_________(填化学式)。
②常温下,若用1LNaOH若用吸收0.01molSO2,完全吸收后溶液中c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),则原NaOH溶液的pH值为________。
(4)连二亚硫酸钠(Na2S2O4)与SO2相似,具有极强的还原性,可用于保存水果食物。现可用如图所示方法通过吸收SO2和NO,获得Na2S2O4和NH4NO3(Ge为铈元素)
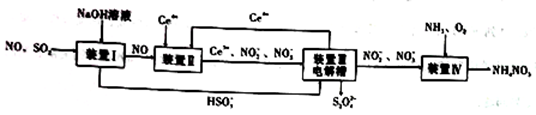
如图
①装置II中,酸性条件下,NO被Ge4+氧化的产物主要是NO3-、NO2-,请写出生成等物质的量的NO3-和NO2-的离子方程式:_______________________________。
②装置III的作用之一是用质子交换膜电解槽电解使得Ge4+再生,同时在另一极生成S2O42-的电极反应式为___________________________。
(5)现今,科学家已研发出比SO2更安全的偏重亚硫酸盐(K2S2O5),工业上常用2KHSO3=K2S2O5+H2O的方法制备。我国要求红酒中添加K2S2O5的标准(按等硫元素质量的SO2计)为0.25g/L。今酿造500吨葡萄酒,需加入K2S2O5的质量为_______。(葡萄酒的密度近似为水,计算结果保留小数点后2位)
-
苯是一种重要的化工原料,可利用苯合成许多有机物。工业上以苯为原料合成环己烷,方法主要是H2还原法:用苯和氢气在高温下发生加成反应,合成环己烷,如图所示。
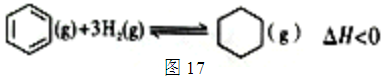
(1)在T℃、2L的密闭容器中反应5min时,消耗标准状况下的H23360mL,用苯表示该反应速率为____________________。
(2)为了提高该反应中苯的转化率,除了可以适当改变反应温度与压强外,还可以采取的措施是____________________。
(3)工业上可用乙炔合成苯:3CH CH(g)=C6H6(l) △H =-636kJ/mol,已知C2H2(g)的燃烧热为
CH(g)=C6H6(l) △H =-636kJ/mol,已知C2H2(g)的燃烧热为
△H =-1300kJ/mol,请写出C6H6(l)燃烧热的热化学方程式:_______________________________ 。
上述反应若保持温度不变,在不同的压强下达到平衡,各成分的物质的量如下表所示:
| | 起始(mol) | 达平衡(mol) | |
| 装置编号 | 总压 | C6H6(g) | H2(g) | C6H12(g) | C6H6(g) | H2(g) | C6H12(g) |
| ① | 10MPa | 1 | 2.8 | 0 | | | |
| ② | 20MPa | 1 | 2.8 | 0 | | | |
| | | | | | | | |
(4)下列事实能够说明装置①中反应达平衡的是___________________(填序号)。
a.气体总压强保持不变
b.单位时间内,每消耗0.15molH2,同时消耗0.05mol环己烷蒸汽
c.苯蒸气的质量保持不变
d.气体的平均摩尔质量保持不变
(5)达平衡时,H:2的物质的量①_____②(填“>”“<”或“=”),理由是___________________。
(6) 环己烷燃烧可放出大量的热,所以工业上可用环己烷作高效燃料电池,请写出环己烷(C6H12)碱性燃料电池负极的电极反应式:_____________________________________________。
(7)列式计算装置①中反应的平衡常数Kp=______________________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
-
在元素周期表的前四周期元素A、B、C、D、E五种元素,其原子序数依次增大,B的p轨道上有两个未成对电子,A原子的第一电离能比B大,C原子的核外电子总数是最外层电子数的3倍D 、E原子的最外层电子数均为1,D的单质是常见的活泼金属, E的次外层电子为全充满结构。
(1)A、B、C三种元素的电负性由大到小的顺序是_________________(填元素符号),E原子的核外电子排布式是________________,第一电离能A>B,原因是________________________________。
(2) A与氢原子形成的18e-分子M的电子式是__________________________,M中A原子的杂化形式是________________________________。
(3)C可形成多种含氧酸,其最高价含氧酸Q的酸根的空间构型是_____________________,另一种含氧酸R的相对分子量比Q小32,且0.01molR可消耗1mol/LNaOH溶液10mL,则含氧酸R的结构式是_______________________ 。(已知:含氧酸中只有羟基上的氢原子可电离与碱反应)
(4)E与O2、NH3可在水溶液中发生反应生成[E(NH3)2]+,该离子在水溶液中呈无色,该离子中E的
化合价为___________,若向该离子中继续通入O2,可生成[E( NH3)4]2+,溶液变为深蓝色,请写出该反应的离子方程式____________________________。
(5)碳原子可形成多种同素异形体,C60便是其中之一,D单质可与C60分子在一定条件下发生化合反应生成一种离子化合物,其阴离子是C60-,该化合物的晶胞结构为NaC1型,则每个晶胞中含有的D+的数目是________个,已知:晶胞中最近的D+之间的距离为a pm,则该物质的密度ρ=___________g/cm3
(只需写出表达式即可)
 互为同系物
互为同系物增大
增大



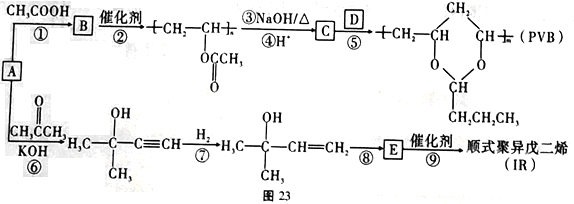
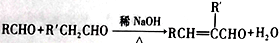 ,(R、R'表示烃基或氢);以A为起始原料,选用必要的无机试剂合成D,写出合成路线_____________________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,(R、R'表示烃基或氢);以A为起始原料,选用必要的无机试剂合成D,写出合成路线_____________________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。