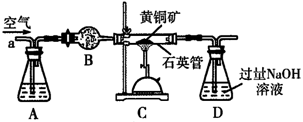
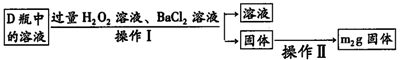
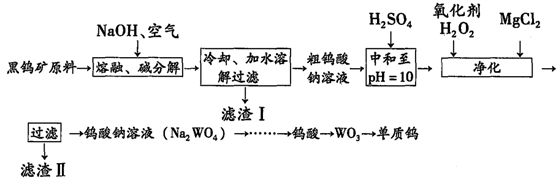
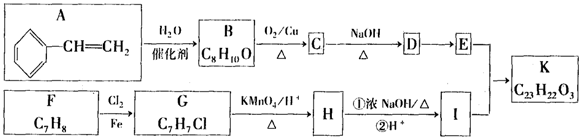
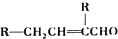-
下表中相关物质的信息都正确的一项是( )
选项
化学式
电子式或含有的化学键类型
物质的性质
与性质相对应的用途
A
NaClO
离子键、共价键
强氧化性
消毒液
B
H2O2
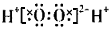
不稳定,易分解
医用消毒剂
C
NH3
共价键
水溶液呈弱碱性
工业制硝酸
D
NaHCO3
离子键
受热易分解
泡沫灭火器
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值.下列说法正确的是( )
A.1 mol-OH(羟基)与l mol NH4+中所含电子数均为10NA
B.25℃时,100 mL pH=l的稀硫酸中,含有的H+数目为0.01 NA
C.室温下,1 L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1 NA
D.标准状况下,2.24LNO2和N2O4混合气体中含0.2 NA个氧原子
难度: 简单查看答案及解析
-
俗称“一滴香”的物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )

A.该有机物的分子式为C8H8O3
B.1 mo1该有机物最多能与 2 mol H2发生加成反应
C.该有机物能发生取代、加成和氧化反应
D.该有机物能与碳酸氢钠反应生成CO2
难度: 中等查看答案及解析
-
第三周期元素R,它的原子最外电子层达到稳定结构所所需的电子数少于次外层与最内层电子数之差,且等于最内层电子数的整数倍,关于R的叙述中正确的是( )
A.常温下,能稳定存在的R的氧化物都是酸性氧化物
B.R的气态氢化物的水溶液具有强酸性
C.R是金属元素
D.R的气态氧化物不能在氧气中燃烧
难度: 中等查看答案及解析
-
下列与实验相关的叙述错误的是( )
A.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的
,液体也不能蒸干
B.给试管中的液体加热时要不时移动试管,以免暴沸
C.可用稀硝酸鉴别MgI、AgNO3、Na2CO3、NaAlO2四种溶液
D.稀释浓硫酸时,如果戴有防护眼罩,可以把水慢慢倒入装有浓硫酸的烧杯中
难度: 简单查看答案及解析
-
锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )

A.放电时,Li+透过固体电解质向Cu极移动
B.放电时,正极的电极反应式为O2+2H2O+4e-═4OH-
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,氧化剂为O2
难度: 中等查看答案及解析
-
25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述正确的是( )

A.25℃时,CH3COOH的电离常数K的值5×10-2.75
B.随pH增大,
增大
C.pH=4的溶液中,c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
D.pH=5的溶液中,c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1 mol•L-1
难度: 中等查看答案及解析