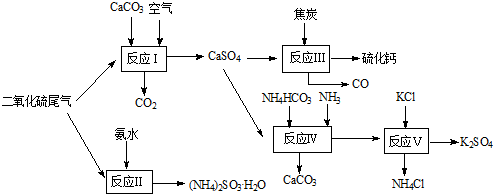
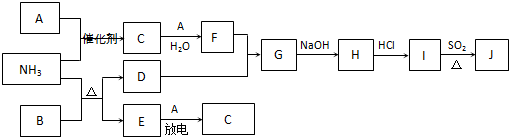
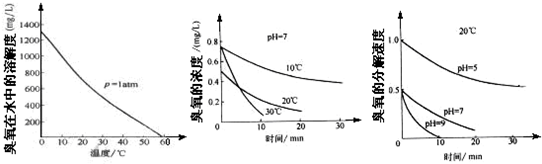
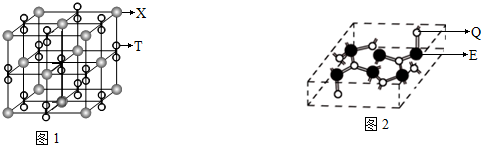-
2009年12月哥本哈根联合国气候变化大会后,低碳生活逐渐成为时代的新时尚.“低碳生活”是指生活作息时所耗用的能量要少,从而减少碳特别是二氧化碳的排放.下列不符合低碳生活概念的是( )
A.把白炽灯换成LED节能灯
B.吃天然食品,穿棉质服装
C.多用电邮、QQ等即时通讯工具,少用传真打印机
D.提倡乘坐公共交通工具、骑自行车或步行的方式出行难度: 中等查看答案及解析
-
下列有关化学用语正确的是( )
A.NH3分子比例模型:
B.质量数为3的重氢原子:D
C.-OH的电子式:
D.乙烯的结构简式:CH2CH2难度: 中等查看答案及解析
-
下列有关化学反应现象和化学原理运用的叙述一定不正确的是( )
A.镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的
B.无机非金属材料光导纤维能够被氢氟酸腐蚀
C.石灰石高温煅烧能分解,与此反应是熵增反应有关
D.漂粉精的主要成分是Ca(ClO)2,Ca(ClO)2难分解,但漂粉精仍需密封保存难度: 中等查看答案及解析
-
下列各组离子在指定溶液中,一定能大量共存的是( )
A.中性溶液:Fe3+、Al3+、NO3-、I-
B.能使甲基橙显橙色的无色溶液:Al3+、NH4+、SO42-、MnO4-
C.常温下,c(H+)/c(OH-)=1×10-12的溶液:K+、AlO2-、CO32-、Na+
D.由水电离出的c(H+)=1×10-12 mol•L-1溶液中:K+、Cl-、HCO3-、Na+难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.1molCl2与1molCH4恰好完全反应,则转移的电子总数为2NA
B.电解精炼铜的过程中转移了NA个电子,阳极溶解32 g铜
C.7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA
D.标准状况下,2.24LCCl4和CH2O的混合物中含有NA个碳原子难度: 中等查看答案及解析
-
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )
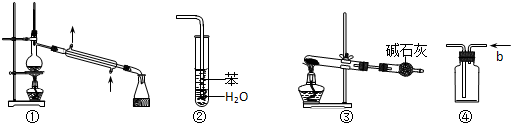
A.装置①常用于分离互不相溶液体混合物
B.装置②可用于吸收HCl气体,并防止倒吸
C.以NH4HCO3为原料,装置③可用于实验室制备少量NH3
D.装置④b口进气可收集CO2、NO等气体难度: 中等查看答案及解析
-
短周期元素A、B、C、D的原子序数依次递增,它们的原子序数之和为32,且原子最外层电子数之和为10;A、C原子的最外层电子数之和等于B原子的次外层电子数;A与C,B与D均为同主族元素.下列叙述正确的是( )
A.四种元素的原子半径:C>D>B>A
B.C元素处于元素周期表中第3周期第ⅡA族
C.最高价氧化物对应的水化物的酸性:B>D
D.B、D的最高价氧化物中,B、D与氧原子之间均为单键难度: 中等查看答案及解析
-
下列说法正确的是( )
A.放热反应一定能自发进行
B.二氧化硫能使品红溶液、溴水褪色,分别说明二氧化硫具漂白性、还原性
C.将AlCl3溶液和NaAlO2溶液分别蒸干和灼烧,所得产物的成分均为Al2O3
D.工业上能通过BaSO4(s)+Na2CO3(aq)⇌BaCO3(s)+Na2SO4(aq)反应先制得BaCO3,再由BaCO3进一步制取可溶性钡盐,是因为Ksp(BaSO4)>Ksp(BaCO3)难度: 中等查看答案及解析
-
下列实验操作、实验现象及解释与结论都正确的是( )
选项 实验操作 实验现象 解释与结论 A 将乙醇与浓硫酸共热至170℃所得气体通入酸性KMnO4溶液中 KMnO4溶液褪色 乙醇发生消去反应,气体中含只有乙烯 B 淀粉溶液和稀H2SO4混合加热,然后加新制的Cu(OH)2悬浊液加热至沸腾 有红色沉淀产生 淀粉水解了,且产物有还原性 C 向甲苯中滴入少量浓溴水,振荡,静置 溶液分层,上层呈橙红色,下层几乎无色 甲苯和溴发生取代反应,使溴水褪色 D 向蔗糖中加入浓硫酸 变黑,放热,体积膨胀,放出刺激性气体 浓硫酸具有脱水性和强氧化性,反应中生成C、SO2和CO2等
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列离子方程式与所述事实相符且正确的是( )
A.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-
B.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3═FeO42-+3Cl-+H2O+H+
C.向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓
D.向含有a mol FeBr2的溶液中,通入x mol Cl2.若x=a,则反应的离子方程式为:2Fe2++2Br-+2Cl2═Br2+2Fe3++4Cl-难度: 中等查看答案及解析
-
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如图所示,有关洋蓟素的说法正确的是( )
A.1mol洋蓟素最多可与11molH2反应
B.不能与氯化铁溶液发生显色反应
C.一定条件下能发生酯化反应和消去反应
D.1mol洋蓟素最多可与5molNaOH反应难度: 中等查看答案及解析
-
下列溶液中离子浓度的关系一定正确的是( )
A.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液:c(CH3COONa)>c(Na2CO3)>c(C6H5ONa )>c(NaOH)
B.pH=3的一元酸HX溶液和pH=11的一元碱MOH溶液等体积混合:c(M+)=c(X-)>c(H+)=c(OH-)
C.NH4HSO4溶液中滴加NaOH至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
D.等物质的量的一元弱酸HX与其钾盐KX的混合溶液中:2c(H+)+c(HX)═2c(OH-)+c(X-)难度: 中等查看答案及解析