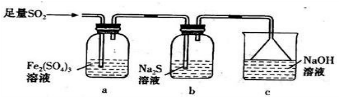
-
化学与社会、生产、生活密切相关。下列说法不正确的是
A.高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”
B.我国油品从国IV汽油升级到国V汽油,有助于减少酸雨、雾霾,提高空气质量
C.臭氧是氧化性极强的淡蓝色气体,可用作自来水的消毒剂
D.科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代普 通DNA链中的P元素
难度: 简单查看答案及解析
-
下列叙述正确的是
A. 硫离子的结构示意图为
B. 核外电子排布相同的微粒化学性质也相同
C. 氢弹中用到的2H、3H互为同位素
D. 同种元素的原子均有相同的质子数和中子数
难度: 简单查看答案及解析
-
下列叙述正确的是
A.Na2O与Na2O2都是碱性氧化物
B.生石灰能与水反应,可用来干燥氨气
C.从海水中提取物质都必须通过化学反应才能实观
D.氯化铝是一种离子型电解质.可用于电解法制铝
难度: 简单查看答案及解析
-
下列说法不正确的是
A.标准状况下,等体积的CH4和CO2所含的共用电子对数相等
B.与NaOH溶液、H2SO4溶液反应产生等量的H2,所需铝粉的质量相等
C.明矾溶液中K +和A13+的物质的量浓度相等
D.1molOH-和17gNH3所含的电子数相等
难度: 简单查看答案及解析
-
向集满CO2铝制易拉罐中加人过量NaOH溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。上述实验过程中没有发生的离子反应是
A.A13++40H-=[Al(OH)4]-
B.Al2O3+2OH-+3H2O=2[A1(OH)4]-
C.CO2+2OH-=CO32-+H2O
D.2A1+2OH-+6H2O=2[Al(OH)4]-+3H2↑
难度: 中等查看答案及解析
-
下列有关实验操作和实验事故处理不正确的是
A. 用蘸浓盐酸的玻璃棒靠近盛放氨气的装置,检査是否漏气
B. 浓硫酸沾在皮肤上,立刻用稀氢氧化钠溶液冲洗
C. 液溴应保存在棕色磨口玻璃塞的试剂瓶中,并加少量水进行水封
D. 为防止被氧化,FeSO4溶液存放在加有少量铁粉的试剂瓶中
难度: 中等查看答案及解析
-
有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06 g Na2CO3和0.84 g NaHCO3,试管中各有10 mL相同浓度的盐酸(如下图),同时将两个侧管中的物质 全部倒入各自的试管中,下列叙述正确的是
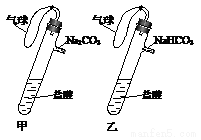
A.甲装置的气球膨胀速率大
B.若最终两气球体积相同,则一定有c(HCl)≥2mol•L-1
C.若最终两气球体积不同,则一定有c(HCI)≤lmol•L-1
D.最终两溶液中Na+、C1-的物质的量相同
难度: 困难查看答案及解析
-
下列实验中,无明显现象的是
A.CO2通人CaCl2溶液中 B.NO2通人FeSO4溶液中
C.NH3通入A1C13溶液中 D.SO2通人Ba( NO3)2溶液中
难度: 简单查看答案及解析
-
短周期元求X、Y、W在元素周期表中的相对位置如下图所示,其中Z为地壳中含量最高的金属元素。下列说法正确的是
X
Y
Z
W
A.工业上电解YW饱和溶液冶炼金属Y
B.气态氢化物的稳定性:W>X
C.简单离子半径的大小顺序:r(Y+)>r(X-)
D.Y、W的最高价氧化物的水化物均能溶解金厲Z
难度: 中等查看答案及解析
-
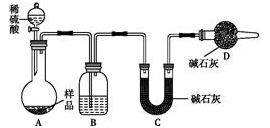
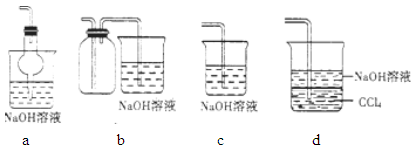
下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是
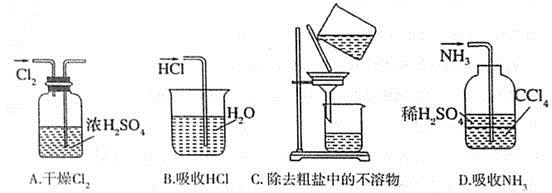
难度: 中等查看答案及解析
-
下列解释事实的化学方程式或离子方程式不正确的是
A.工业上可用电解法制备Mg:MgCl2(熔融)
Mg+Cl2↑
B.用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+Fe2++14H+=2Cr3++Fe3++7H2O
C.用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)
CaCO3(s)+Na2SO4(aq)
D.向Ca(ClO)2溶液中通入少量CO2:Ca2++2C1O-+H2O+CO2=2HC1O+CaCO3↓
难度: 中等查看答案及解析
-
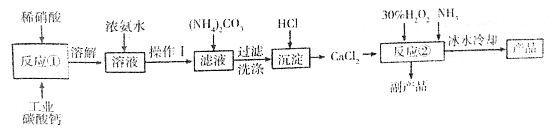
下列物质的转化在给定条件下不容易实现的是
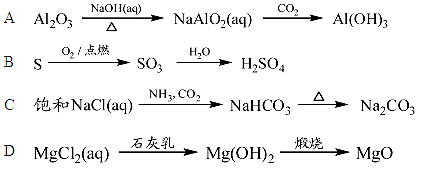
难度: 中等查看答案及解析
-
探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是
A.将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B.将湿润的红色石蕊试纸放入集有氨气的集气瓶中,试纸由红色变为蓝色,说明氨水呈碱性
C.加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定
D.将红热的pt丝伸入如图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氧气的直接氧化产物为NO2
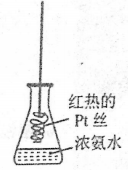
难度: 中等查看答案及解析
-
有一瓶Na2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀。对此实验下述结论正确的是
A.加硝酸后的不溶性沉淀一定是BaSO4
B.Na2SO3已部分被空气中的氧气氧化
C.加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4
D.此实验能确定Na2SO3是否被部分氧化
难度: 中等查看答案及解析
-
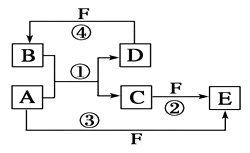
已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是
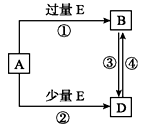
A.若A是铁,则E可能为稀硝酸
B.若A是CuO,E是碳,则B为CO
C.若A是NaOH溶液,E是CO2,则B为NaHCO3
D.若A是A1C13溶液,E可能是稀氨水
难度: 中等查看答案及解析
-
某溶液中可能含有H+、NH4+、Fe3+、CO32-、SO42-、NO3-中的几种。
①若加入锌粒,产生无色无味的气体,且在空气中不变色;
②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加人NaO的物质的量之间的关系如下图所示。则下列说法正确的是
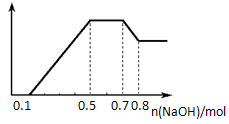
A.溶液中的阳离子只有H+、Mg2+、Al3 +
B.溶液中一定不含CO32-,可能含有SO42-和NO3-
C.溶液中n(NH4+)=0.2mol
D.n(H+):n(Al3+):n(Mg2+)=1:1:1
难度: 困难查看答案及解析