-
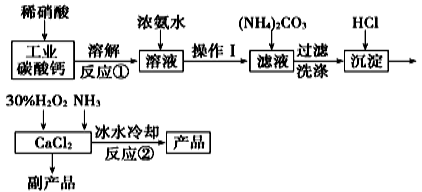
【化学——化学与技术】过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙,其主要流程如下:

已知:CaO2·8H2O呈白色微溶于水,加热至350℃左右开始分解放出氧气,425℃分解完全。
(1)写出反应①中氧化还原反应的离子方程式:___________________________。
(2)向反应①后的溶液中加浓氨水的目的是:___________,________(用方程式表示)
(3)反应②常用冰水控制温度在0℃左右,其可能原因是(写出两种):
①__________________________;②__________________________。
(4)测定产品中CaO2的含量的实验步骤是
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。已知:I2+2S2O===2I-+S4O。
某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________(填“不受影响”“偏低”或“偏高”),原因是____________________.
-
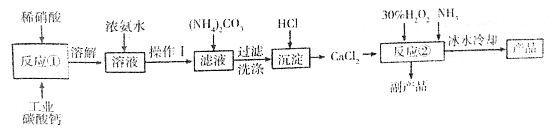
过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙,其主要流程如下:
已知:CaO2·8H2O呈白色微溶于水。
(1)写出反应①中氧化还原反应的离子方程式: ______________。
(2)向反应①后的溶液中加浓氨水的目的是: __________________。
(3)反应②常用冰水控制温度在0℃左右,其可能原因是(写出两种):
①__________________;②______________。
(4)测定产品中CaO2的含量的实验步骤是
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴滴入浓度为c mol·L-1的Na2S2O3标准溶液至反应终点,消耗Na2S2O3溶液V mL。
已知:I2+2S2O ===2I-+S4O
===2I-+S4O 。
。
①滴定终点的现象为____________,产品中CaO2的质量分数为_________________
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________ (填“不受影响”“偏低”或“偏高”),原因是_____________.
-
过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙,其主要流程如下:
已知:CaO2·8H2O呈白色微溶于水,加热至350℃左右开始分解放出氧气,425℃分解完全。
(1)写出反应①屮氧化还原反应的离子方程式___________________。
(2)向反应①后的溶液中加浓氨水的目的是_________________。
(3)写出反应②的化学方程式_________________;反应②常用冰水控制温度在0℃左右.其可能原因是(写出两种):
①________________;②________________。
(4)测定产品中CaO2的含量的实验步骤是
第一步:准确称取a g产品于有塞锥形瓶中,加人适量蒸馏水和过量的b gKI晶体,再滴人少量2 mol • L-1H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加人几滴淀粉溶液。
第三步:逐滴加入浓度为c mol • L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。已知:I2+2S2O32- =2I-+S4O62-。
某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能__________(填“不受影响”“偏低”或“偏高”),原因是________________。
-
过氧化钙晶体(CaO2·8H2O)呈白色,微溶于水,加热至350℃左右开
始分解放出氧气。过氧化钙可用于改善地表水质、处理含重金属粒子废水、应急供
氧等。实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再
用纯的碳酸钙制取过氧化钙,其主要流程如下:
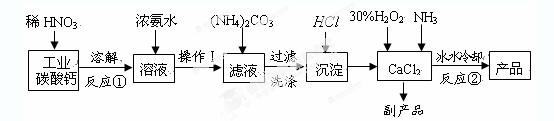
回答下列问题:
整个流程中涉及的化学反应属于氧化还原反应的有个,请写出其中任意一个的离子方程式:;
(2)反应②生成CaO2·8H2O的化学反应方程式为;
反应时用冰水冷却的主要原因是;
(3)将过氧化钙晶体在坩埚中加热并逐渐升高温度。测得样品质量随温度的变化如图曲线所示,则350℃以后所得固体物质的化学式为。

-
过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:

已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是 ;
(2)检验“水洗”是否合格的方法是 ;
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种):
① ;
② 。
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知:I2+2S2O32-=2I-+S4O62-】
①CaO2的质量分数为 (用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“不受影响”、“偏低”或“偏高”),原因是 。
-
(12分)过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
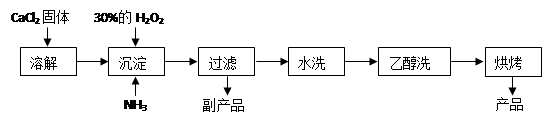
已知CaO2·8H2O呈白色,微溶于水,加热至350℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是________;
(2)检验“水洗”是否合格的方法是;
(3)沉淀时常用冰水控制温度在0℃左右,其可能原因是(写出两种):
①________;②________。
(4)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L—1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
[已知:I2+2S2O32-= 2I-+S4O62-]
①CaO2的质量分数为________ (用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________(填“不受影响”、“偏低”或“偏高”),原因是_______________。
-
(14分)过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:

已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是________;
(2)检验“水洗”是否合格的方法是________;
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种):
①____________;②____________。
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知: 】
】
①CaO2的质量分数为____________(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________(填“不受影响”、“偏低”或“偏高”),原因是_________。
-
(12分)过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
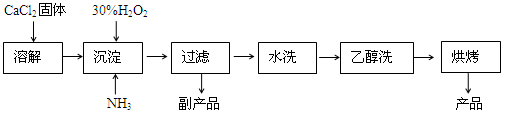
已知CaO2·8H2O呈白色,微溶于水,加热至350℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是 。
(2)沉淀时常用冰水控制温度在0℃左右,其可能原因是(写出两种):
① ;② 。
(3)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【己知:I2+2S2O32-=2I-+S4O62-】
①CaO2的质量分数为 (用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“不受影响”、“偏低”或“偏高”),原因是 。
-
(14分)过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:

已知CaO2·8H2O呈白色,微溶于水,加热至350℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是▲ ;
(2)检验“水洗”是否合格的方法是▲ ;
(3)沉淀时常用冰水控制温度在0℃左右,其可能原因是(写出两种):
①▲ ;②▲ 。
(4)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L—1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
已知:I2+2S2O32-= 2I-+S4O62-
①CaO2的质量分数为▲ (用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能▲ (填“不受影响”、“偏低”或“偏高”),原因是_______________
-
过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:

已知:CaO2·8H2O是一种白色固体,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)完成用上述方法制取CaO2·8H2O的化学方程式是:CaCl2+H2O2+2NH3+8H2O==CaO2·8H2O↓+________;
(2)检验“水洗”是否合格的操作方法是_________________________________________;
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种):
① ; ②____________________________。
(4)测定产品中CaO2的含量的实验步骤:【已知:I2+2S2O32-=2I-+S4O62-】
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
①CaO2的质量分数为____________(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________(填“不受影响”、“偏低”或“偏高”),原因是___________________。










