-
下列化学名词正确的是 ( )
A.三溴笨酚 B.烧碱 C.硬脂酸甘油脂 D.石碳酸
难度: 中等查看答案及解析
-
不属于中学化学的基本理论知识范畴的是 ( )
A.勒夏特列原理 B.元素周期律
C.石油的成分 D.电离平衡常数
难度: 中等查看答案及解析
-
以下各种表示式中,最能反映氮原子核外电子运动状态的是 ( )
A.
B.
C.1s22s22p3 D.
难度: 中等查看答案及解析
-
原子核外电子填充在6个轨道上的元素有 ( )
A.1种 B.2种 C.3种 D.4种
难度: 中等查看答案及解析
-
氯碱工业中,与铁丝网连接的是电源的 ( )
A.负极 B.正极 C.阴极 D.阳极
难度: 中等查看答案及解析
-
下列物质中,各元素原子的最外层电子全部参加成键的是 ( )
A.氟化氢 B.水 C.硅化氢 D.二氧化碳
难度: 中等查看答案及解析
-
在只用水和若干试管的条件下,下列各组物质中无法鉴别的是 ( )
A.硝基苯、苯、乙醇三种液体
B.硫酸钠、硝酸钾、氯化钡三种固体
C.硫磺、过氧化钠、氯化钙三种固体
D.氯化铝、偏铝酸钠、烧碱三种固体
难度: 中等查看答案及解析
-
在一密闭容器中,反应aX(g)+bY(g)
cZ(g)达到平衡时的平衡常数为K1;在温度不变的条件下将容器体积压缩至原来的一半,达到新的平衡后Y的浓度为原来的1.6倍,平衡常数为K2。则K1 与K2的大小关系是 ( )
A.K1=K2 B.K1<K2 C.K1>K2 D.无法确定
难度: 中等查看答案及解析
-
下列反应中生成物总能量高于反应物总能量的是 ( )
A.氧化钙溶于水 B.铁粉与硫粉共热
C.强酸强碱中和 D.碳酸钙分解
难度: 中等查看答案及解析
-
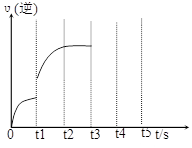
有一种黄棕色气体X,其体积为20 mL,完全分解后生成10 mL氯气和20 mL氧气(同温同压下测定)。判断X为三原子分子的依据有:①质量守恒定律;②能量守恒定律;③能量最低原理;④阿佛加德罗定律。合理的组合是 ( )
A.①② B.①④ C.②③ D.②④
难度: 中等查看答案及解析
-
2008年北京奥运会“祥云”火炬用的是环保型燃料—丙烷(C3H8),下列有关烷烃的说法不正确的是 ( )
A.丙烷分子中三个碳原子共平面 B.丁烷的一氯代物共有4种
C.正丁烷的4个碳原子在一直线上 D.CnH2n+2的烃中含有3n+1个共价键
难度: 中等查看答案及解析
-
在容积恒定的密闭容器中,存在下列平衡:2HBr(g)H2(g)+Br2(g)-Q,若升高温度,发生改变的是 ( )
A.分子数 B.压强 C.密度 D.平均摩尔质量
难度: 中等查看答案及解析
-
有五瓶溶液分别是:①10 mL 0.6 mol/L NaOH溶液;②20 mL 0.5 mol/L H2SO4溶液;③30 mL 0.4 mol/L HCl溶液;④40 mL 0.3 mol/L CH3COOH溶液;⑤50 mL 0.2 mol/L蔗糖溶液。以上各瓶溶液所含离子、分子总数的大小顺序是 ( )
A.①>②>③>④>⑤ B.②>①>③>④>⑤
C.②>③>④>①>⑤ D.⑤>④>③>②>①
难度: 中等查看答案及解析
-
诺龙属于国际奥委会明确规定的违禁药物中的合成代谢类类固醇,其结构简式如右图所示。

下列关于诺龙性质的说法中不正确的是( )
A.能与氢气反应
B.能与金属钠反应
C.能与NaOH溶液反应
D.不能与新制Cu(OH)2悬浊液反应
难度: 中等查看答案及解析
-
若把元素所处的族分为主族、副族、Ⅷ族和0族四类,下列数字分别为元素原子的次外层和最外层上的电子数,其中可以肯定为副族元素的是 ( )
A.18,1 B.8,2 C.18,3 D.18,8
难度: 中等查看答案及解析
-
氯化钠是典型的离子晶体,下列有关氯化钠晶体结构的有关叙述错误的是( )
A.钠离子与氯离子之间通过静电吸引结合在一起
B.与某个钠离子最接近的钠离子有12个
C.某个钠离子周围的氯离子围成的空间结构为正八面体
D.晶体中钠离子的半径比氯离子的半径小
难度: 中等查看答案及解析
-
若以ω1和ω2分别表示浓度为a mol/L和b mol/L硫酸溶液的质量分数,且知2a=b,则下列推断中,正确的是 ( )
A.2ω1=ω2 B.2ω2=ω1
C.ω1>2ω2 D.ω1<ω2<2ω1
难度: 中等查看答案及解析
-
将下列浓溶液蒸干并灼烧,可以得到原溶质的是 ( )
A.氯化钠 B.碳酸氢钠
C.偏铝酸钠 D.氯化铁
难度: 中等查看答案及解析
-
下列两种气体的分子数一定相等的是 ( )
A.等体积等密度的CO和C2H4 B.等温等体积的O2和N2
C.等压等体积的N2和CO2 D.质量相等、密度不等的N2和C2H4
难度: 中等查看答案及解析
-
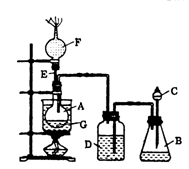
《Inorganic Syntheses》(无机合成)一书中,有一如右图所示的装置,用以制备某种干燥的纯净气体。
该装置中所装的药品正确的是
A.A中装浓硫酸,B中装浓盐酸
B.A中装浓盐酸,B中装浓硫酸
C.A中装氢氧化钠浓溶液,B中装浓氨水
D.A中装浓氨水,B中装氢氧化钠浓溶液
难度: 中等查看答案及解析
-
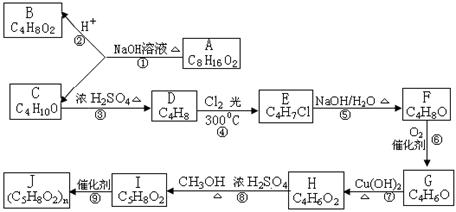
已知HA、H2B为二种弱酸,HA的电离常数为KHA,H2B的电离常数为K1、K2,其大小依次是K1>KHA>K2,由此可以推测以下各反应中不
能进行的是 ( )
A.NaA+H2B
NaHB+HA B.2NaA+H2B
Na2B+2HA
C.NaHB+HA
NaA+H2B D.Na2B+HA
NaHB+NaA
难度: 中等查看答案及解析
-
在含Na2CO3和NaHCO3各1 mol的混合溶液中加入0.5 mol下列物质,其中能使HCO3―的数目均减少,CO32―数目增加的是 ( )
A.浓盐酸 B.Na2SO4浓溶液
C.NaOH浓溶液 D.Ba(OH)2浓溶液
难度: 中等查看答案及解析