-
下列表示氮原子结构的化学用语中,对核外电子运动状态描述正确且能据此确定电子能级的是( )
A.
B.
C.1s22s22p3
D.难度: 中等查看答案及解析
-
以下四种标签,适合贴在无水乙醇试剂瓶上的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质.以下关于蛋白质的说法不正确的是( )
A.构成蛋白质的氨基酸既能与强酸又能与强碱反应
B.氨基酸能发生缩聚反应
C.凡含有“-CO-NH-”的化合物均为蛋白质
D.浓硝酸会使某些蛋白质变黄难度: 中等查看答案及解析
-
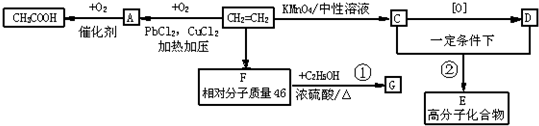
哥本哈根会议的一个重要议题是“减少温室气体排放”,化学家们正在为此努力.如果让CO2与H2在一定条件下以1:3混合反应,可生成某种重要化工原料和水.该化工原料可能是( )
A.芳香烃
B.烯烃
C.烷烃
D.炔烃难度: 中等查看答案及解析
-
大胆、科学的假设与猜想是科学探究的先导和价值所在.下列在假设(猜想)引导下的探究肯定没有意义的是( )
A.探究Na与H2O反应可能产生O2
B.探究CH4分子是否平面结构
C.探究含有酚酞的NaOH溶液中滴入Cl2水,溶液褪色的原因可能是HClO的漂白性
D.探究浓H2SO4与Cu在一定条件下反应产生的黑色物质中可能有CuS难度: 中等查看答案及解析
-
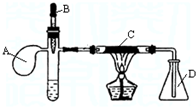
选用的相关仪器符合实验要求的是( )
A.
存放浓硝酸
B.
准确量取7.60mL盐酸
C.
实验室制乙烯
D.
分离水和乙酸乙酯难度: 中等查看答案及解析
-
有关化学键和晶体的下列叙述中错误的是( )
A.稀有气体的原子能形成分子晶体
B.金属晶体的熔沸点不一定很高
C.分子晶体中,分子间作用力越大分子越稳定
D.离子晶体中一定存在离子键难度: 中等查看答案及解析
-
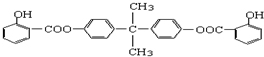
膳食纤维具有突出的保健功能,人体的“第七营养素”木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )
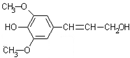
A.芥子醇的分子式是C11H14O4,属于芳香烃
B.芥子醇与浓溴水既能发生取代反应又能发生加成反应
C.芥子醇能发生氧化、取代、加成、聚合反应
D.1mol芥子醇能与含2mol NaOH的水溶液完全反应难度: 中等查看答案及解析
-
对实验现象的描述肯定错误的是( )
A.氢气在氯气中燃烧,有白雾生成
B.氯化钙溶液中通入二氧化碳,溶液没有变化
C.溴水中加入足量碘化钾固体,溶液褪成无色
D.将灼烧发黑的铜丝趁热插入乙醇中,铜丝表面黑色消失难度: 中等查看答案及解析
-
下列实验方案合理的是( )
A.蒸干FeCl3溶液得到FeCl3固体
B.用催化加氢的方法除去乙烷中的乙烯
C.向淀粉碘化钾溶液中滴加氯水,溶液变为蓝色,说明Cl2的氧化性强于I2
D.在滴有酚酞的Na2CO3溶液中加入BaCl2溶液,溶液褪色,证明BaCl2溶液有酸性难度: 中等查看答案及解析
-
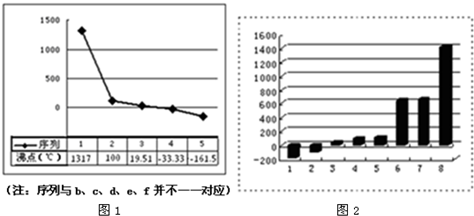
利用某些有机物的同分异构体间的转化可用来贮存热能,如降冰片二烯(NBD)经太阳照射后转化成四环烷(Q)的反应,下列说法不正确的是( )
A.NBD、Q、甲苯三者互为同系物
B.降低温度有利于Q转化为NBD
C.一定条件下遇HCl时Q比NBD稳定
D.NBD、Q、甲苯三者是同分异构体难度: 中等查看答案及解析
-
关于如图装置所示的两个实验,说法正确的是( )
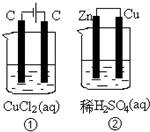
A.①②中均发生了化学变化,均是化学能转变为电能的装置
B.②中电流方向是从Zn经导线流入Cu
C.反应开始阶段,①②中均有氢气产生
D.电极反应式:①中阳极 2Cl--2e→Cl2↑②中正极 2H++2e→H2↑难度: 中等查看答案及解析
-
在H2SO4、HNO3、NH3的工业生产中,具有的共同点是( )
A.使用H2作原料
B.使用催化剂
C.使用吸收塔设备
D.使用尾气吸收装置难度: 中等查看答案及解析
-
一定条件下密闭容器中发生反应:4NH3(g)+5O2(g)
4NO (g)+6H2O(g)
反应过程中能量变化如图所示,下列说法正确的是( )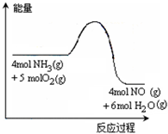
A.降低温度可以加快正反应速率
B.反应体系中加入催化剂可增加反应热
C.降低温度可以提高NH3的转化率
D.增加空气的量可以提高混合气体中NO的体积分数难度: 中等查看答案及解析
-
下列物质中所含碳原子数最接近阿伏伽德罗常数的是( )
A.1 mol碳单质
B.0.5L 1mol/L的醋酸溶液中CH3COOH、CH3COO-之和
C.标准状况下,12g碳单质
D.标准状况下,22.4L CO2气体难度: 中等查看答案及解析
-
下列装置能达到实验目的是( )
A.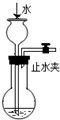
检查装置气密性
B.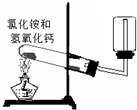
实验室制取并收集氨气
C.
吸收HCl并防止倒吸
D.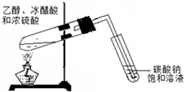
实验室制乙酸乙酯难度: 中等查看答案及解析
-
在5mL 0.05mol/L的某金属氯化物溶液中,滴加0.1mol/L AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为( )
A.+1
B.+2
C.+3
D.+4难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.硫酸铜溶液与足量氢氧化钡溶液混合:Ba2++SO42-→BaSO4↓
B.等体积、等浓度的澄清石灰水与碳酸氢铵溶液混合:Ca2++2OH-+NH4++HCO3-═CaCO3↓+NH3•H2O+H2O
C.氯化铝溶液中加入过量浓氨水:Al3++3 NH3•H2O═Al(OH)3↓+3 NH4+
D.用K37ClO3与浓盐酸制氯气:37ClO3-+6H++6Cl-→37Cl-+3Cl2↑+3H2O难度: 中等查看答案及解析
-
根据表中提供的数据,判断下列说法正确的是( )化学式 电离常数
(25℃)HCN 4.9×l0-10 H2CO3 K1=4.3×l0-7
K2=5.6×l0-11
A.等浓度的NaCN、NaHCO3、Na2CO3溶液中,pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)
B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)=c(CN-),则a一定大于b
C.等浓度的NaCN、NaHCO3混合溶液中,c(Na+)+c(H+)=c(CN-)+c(HCO3-)+c(OH-)
D.NaCN溶液中通入少量CO2,发生的反应可表示为2NaCN+H2O+CO2→2HCN+Na2CO3难度: 中等查看答案及解析
-
据报道,科学家发现了如下反应:O2+PtF6→O2(PtF6).已知O2(PtF6) 为离子化合物,其中Pt为+5价.对于此反应,下列说法正确的是( )
A.此反应是非氧化还原反应
B.O2(PtF6) 中氧元素的化合价是+1价
C.在此反应中,O2是还原剂,PtF6是氧化剂
D.此反应中,每生成1mol O2(PtF6)转移1mol 电子难度: 中等查看答案及解析
-
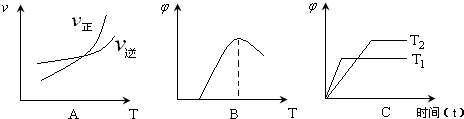
下列坐标图所表示的量的关系正确的是( )
A.
一元饱和羧酸中碳原子数x与羧酸的溶解度y的关系
B.
亚硫酸钠溶液敞口放置天数x与溶液质量y的关系
C.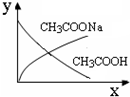
一定量稀NaOH溶液滴到CH3COOH稀溶液中,NaOH滴加量x与有关物质浓度y的关系
D.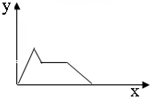
CO2缓慢通入含KOH和 Ca(OH)2的溶液中,CO2的量x与沉淀的量y的关系难度: 中等查看答案及解析
-
将51.2g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合气体共0.8mol,这些气体恰好能被500mL 2mol/L NaOH溶液完全吸收,溶液中生成NaNO3和NaNO2,则原混合气体中NO的物质的量为( )
A.0.3mol
B.0.4mol
C.0.5mol
D.0.6mol难度: 中等查看答案及解析