-
能正确表示下列反应的离子方程式为
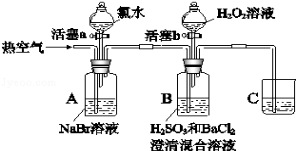
A.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S
B.NH4HCO3溶于过量的NaOH溶液中:HCO3−+OH−=CO32−+H2O
C.少量SO2通入苯酚钠溶液中:C6H5O−+SO2+H2O=C6H5OH+HSO3−
D.大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO−+CO2↑+H2O
难度: 困难查看答案及解析
-
科学家最近用金属钠还原CCl4和SiCl4制得一种一维SiC纳米捧。相关反应的化学方程式为:8Na+CCl4+SiCl4=SiC+8NaCl。下列说法不正确的是
A.一维SiC纳米棒“比表面积”大,对微小粒子有较强的吸附能力
B.上述反应中SiC既是氧化产物又是还原产物
C.SiCl4是由极性键构成的非极性分子
D.每生成1mol SiC转移8mol电子
难度: 中等查看答案及解析
-
25 ℃时,浓度均为0.1 mol·L-1的HA溶液和BOH溶液,pH分别是1和11。下列说
法正确的是
A.BOH溶于水,其电离方程式是BOH===B++OH-
B.若一定量的上述两溶液混合后pH=7,则c(A-)=c(B+)
C.在0.1 mol·L-1 BA溶液中,c(B+)>c(A-)>c(OH-)>c(H+)
D.若将0.1 mol·L-1 的BOH溶液稀释至0.001 mol·L-1,则溶液的pH=9
难度: 困难查看答案及解析
-
在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)
Y(g)+ Z(g) △H<0容器内气体总压强p随反应时间t的变化关系如图所示。 以下分析正确的是
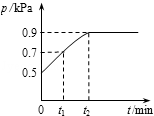
A.从反应开始到t1时的平均反应速率v(X) = 0.2/t1 mol/(L•min)
B.该温度下此反应的平衡常数K = 0.32
C.欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量
D.其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大
难度: 困难查看答案及解析
-
有机物Q的分子式为C5H10O2,一定条件下Q遇NaHCO3、Na均能产生气体,且生成气体体积比(同温同压)为2:1,则Q的结构最多有
A.4种 B.6种 C.8种 D.7种
难度: 中等查看答案及解析
-
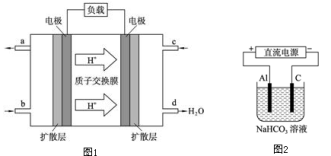
某种可充电聚合物锂离子电池放电时的反应为Li1﹣xCoO2 + LixC6 = 6C + LiCoO2,其工作原理示意图如图。下列说法不正确的是
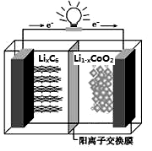
A. 放电时LixC6发生氧化反应
B. 充电时将电池的负极与外接电源的负极相连
C. 充电时,Li+通过阳离子交换膜从左向右移动
D. 放电时,电池的正极反应为:Li1﹣xCoO2+xLi++xe﹣═LiCoO2
难度: 困难查看答案及解析
-
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌。“一滴香”的分子结构如图所示,下列说法正确的是
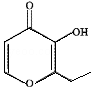
A.该有机物的分子式为C7H7O3
B.1mol该有机物最多能与2mol H2发生加成反应
C.该有机物能发生取代、加成和氧化反应
D.该有机物的一种含苯环的同分异构体能发生银镜反应
难度: 中等查看答案及解析