-
原子序数依次递增且都小于36的X、Y、Z、Q、W四种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Q原子基态时2p原子轨道上有2个未成对的电子,W元素的原子结构中3d能级有4个未成对电子。回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为 ,Y2X2分子中σ键和π键个数比为 。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
(4)元素W能形成多种配合物,如:W(CO)5等。
①基态W3+的M层电子排布式为 。
②W(CO)5常温下呈液态,熔点为—20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断W(CO)x晶体属于 (填晶体类型),该晶体中W的化合价为 。
(5)下列有关的说法正确的是 。
A.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
B.电负性顺序:X<Y<Z<Q
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.H2 YO3的分子结构中含有一个非羟基氧,故其为中强酸
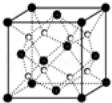
(6)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含ρ、NA的计算式表示)
-
[化学一选修3:物质结构与性质](15分)
(1)原子序数小于36的X、Y、Z、W四种元素,其中X是元素周期表原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未 成对的电子,w的原子序数为29。回答下列问题:
①Y2X2分子中Y原子轨道的杂化类型为_________,1molY2X2含有 键的数目为____ __________________.
键的数目为____ __________________.
②化合物ZX3的沸点比化台物YX4的高,其主要原因是_____________。
③元素Y的一种氧化物与元素z的一种氧化物互为等电子体,元素z的这种氧化物的分子式是_____________。
(2)铁元素能形成多种配合物,如:Fe(CO)x
①基态Fe3+的M层电子排布式为___________________________。
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18.则x=_________。常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于
(填晶体类型):
(3)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为_________。已知该晶胞的密度为 g/cm
g/cm ,阿伏加德罗常数为
,阿伏加德罗常数为 ,求晶胞边长a=________cm。(用含
,求晶胞边长a=________cm。(用含 的计算式表示)
的计算式表示)

(4)下列有关的说法正确的是_____________。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能Ca0比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
-
【化学---选修3:物质结构与性质】原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时最外层电子数是其内层电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构。回答下列问题:
(1)W基态原子的价电子排布式____________;Y2X2分子中Y原子轨道的杂化类型为______。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是_____________。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是____________。Y60用做比金属及其合金更为有效的新型吸氢材料,其分子结构为球形32面体,它是由60个Y原子以20个六元环和12个五元环连接而成的具有30个Y=Y键的足球状空心对称分子。则该分子中σ键和π键的个数比_____;36gY60最多可以吸收标准状况下的氢气_____L。
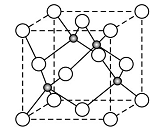
(4)元素W的一种氯化物晶体的晶胞结构如右图所示,该氯化物的化学式是___________,该晶体中W的配位数为___________。它可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3,反应的化学方程式为_________。
-
(8分)原子序数小于36的X、Y、Z、W四种元素,其中X是周期表中半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
(1)1mol Y2X2含有σ键的数目为________。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是________。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是________。
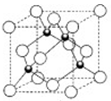
(4)元素W的一种氯化物晶体的晶胞结构如图13所示,该氯化物的化学式是________。
-
原子序数依次递增的A、B、C、D、E五种元素,其中只有E是第四周期元素,A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍。回答下列问题:
(1)E的+2价离子基态核外电子排布式为____。
(2)A、B、C、D原子中,电负性最大的是____(填元素符号)。
(3)1 mol B2A4分子中σ键的数目为____。B4A6为链状结构,其分子中B原子轨道的杂化类型只有一种,则杂化类型为____。
(4)元素B的一种氧化物与元素C的一种氧化物互为等电子体,元素C的这种氧化物的分子空间构型为____。
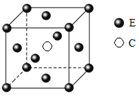
(5)E和C形成的一种化合物的晶胞结构如图所示,该化合物的化学式为____。
-
X、Y、Z、W四种元素原子序数依次增大且均小于36。Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒,W基态原子有10个价电子。 回答下列问题(以下问题均以推知元素符号作答):
(1)若YX3与X2Z、YX2-与ZX-、Y3-与Z2-性质相似,请写出Mg(YX2)2在一定条件下分解的化学反应方程式_________________。
(2)已知X2Z晶胞中X2Z分子的空间排列方式与金刚石晶胞类似,相似的原因与下列因素有关的是______。
①氢键的方向性 ②氢键的饱和性 ③水中氧的杂化方式与金刚石中碳的杂化方式一样 ④晶体类型相似
(3) WZ是一种功能材料,已被广泛用于电池电极、催化剂、半导体、玻璃染色剂等方面。工业上常以W(YZ3)·6X2Z和尿素[CO(NH2)2]为原料制备。
①W2+的基态核外电子排布式为_________,其核外电子有________种运动状态。
②尿素分子中碳原子的杂化方式为_________,1mol尿素分子中含有的σ键数为______NA。
③YZ3-的空间构型________,与之互为等电子体的阴离子如________,中性分子如________;HYZ3与HYZ2 中酸性偏强的是(写化学式)__________。
④WZ晶体的结构与NaCl相同,但天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种WZ晶体中就存在如下图所示的缺陷:一个W2+空缺,另有两个W2+被两个W3+所取代。其结果晶体仍呈电中性,但化合物中W和Z的比值却发生了变化。经测定某样品中W3+与W2+的离子数之比为6:91。若该晶体的化学式为WxZ,则x=_____。

-
【化学–选修3:物质结构与性质】(15分)
X、Y、Z、W四种元素原子序数依次增大且均小于36。 Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒, W基态原子有10个价电子。回答下列问题(以下问题均以推知元素符号作答):
(1)若 YX3与X2Z﹑YX2-与ZX-﹑Y3-与Z2-性质相似,请写出Mg(YX2)2在一定条件下分解的化学反应方程式
⑵已知0℃时X2Z的密度为a g/cm3,其晶胞中X2Z分子的空间排列方式与金刚石晶胞类似,相似的原因是 。两个X2Z分子间的最近距离为 pm(用a和NA表示)。 已知X2Y的升华热是51 kJ/mol,除氢键外,X2Z分子间还存在范德华力(11 kJ/mol),则X2Z晶体中氢键的“键能”是 kJ/mol。
⑶ WZ是一种功能材料,已被广泛用于电池电极、催化剂、半导体、玻璃染色剂等方面。工业上常以W(YZ3)2·6X2Z和尿素[CO(NH2)2]为原料制备。
①W2+的基态核外电子排布式为 ,其核外电子有 种运动状态。
②尿素分子中碳原子的杂化方式为 ,1 mol尿素分子中含有的σ键数为 。
③YZ3-的空间构型 。
 ④WZ晶体的结构与NaCl相同,但天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种WZ晶体中就存在如图所示的缺陷:一个W2+空缺,另有两个W2+被两个W3+所取代。其结果晶体仍呈电中性,但化合物中W和Z的比值却发生了变化。经测定某样品中W3+与W2+的离子数之比为6∶91。若该晶体的化学式为WxZ,则x= 。
④WZ晶体的结构与NaCl相同,但天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种WZ晶体中就存在如图所示的缺陷:一个W2+空缺,另有两个W2+被两个W3+所取代。其结果晶体仍呈电中性,但化合物中W和Z的比值却发生了变化。经测定某样品中W3+与W2+的离子数之比为6∶91。若该晶体的化学式为WxZ,则x= 。
-
原子序数依次增加的X、Y、Z、W四种元素原子序数均小于36, Y基态原子最外层电子数是其内层电子总数的3倍,X、W基态原子是同周期元素中未成对电子数最多的原子,X与Z的原子核内质子数之和等于W原子核内质子数,Z基态原子只有1个未成对的电子。
回答下列问题:
(1)已知化合物XZ3与H2Y(Y的氢化物)发生反应的化学方程式为XZ3+H2Y→XH3+HZY,则元素的电负性:Y Z(填“大于”或“小于”),化合物HZY分子的空间构型为 。
(2)X的一种氢化物的相对分子质量为32,1mol该氢化物中的σ键数是 ,该氢化物在水中的溶解性如何?主要原因是什么?
(3)元素Y 3个原子形成的单质分子与元素X、Y形成的一种离子互为等电子体,这种离子的化学式是 。

(4)基态W原子的电子排布式是 ,元素Y和W的一种化合物的晶体结构如右图所示,该晶体的化学式为 。(W处于晶体内部,Y分别处于晶胞面心、顶点、和内部)
(5)金属原子 (选填“钾”、“镁”、“铜”)形成的晶体的堆积方式,与上述晶胞中Y离子的堆积方式相同。
-
原子序数依次增加的X、Y、Z、W四种元素原子序数均小于36,Y基态原子最外层电子数是其内层电子总数的3倍,X、W基态原子是同周期元素中未成对电子数最多的原子,X与Z的原子核内质子数之和等于W原子核内质子数,Z基态原子只有1个未成对的电子。回答下列问题:
(1)已知化合物XZ3与H2Y(Y的氢化物)发生反应的化学方程式为XZ3+H2Y→XH3+HZY,则元素的电负性:Y______Z(填“大于”或“小于”),化合物HZY分子的空间构型为______。
(2)X的一种氢化物的相对分子质量为32,1mol该氢化物中的σ键数是______。
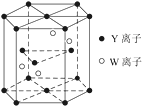
(3)①元素Y的一种单质分子与元素X、Y形成的一种离子互为等电子体,这两种微粒的化学式是_______、________。
②基态W原子的电子排布式是_______________。
(4)元素Y和W的一种化合物的晶体结构如图所示,该晶体的化学式为______;金属原子______(选填“钾”、“镁”、“铜”)形成的晶体的堆积方式,与上述晶胞中Y离子的堆积方式相同。
-
(11分)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。
回答下列问题:
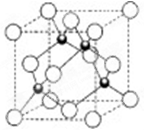
(1)Y2X2分子中Y原子轨道的杂化类型为________,1mol Y2X2含有σ键的数目为________。
(2)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是________。
(3)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是________,它可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3,反应的化学方程式为________









