-
化学与环境保护密切相关,下列叙述正确的是( )
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.处理废水时加入明矾作为消毒剂可以除去水中的杂质
C.PM2.5(2.5微米以下的细颗粒物)主要来自化石燃料 的燃烧
D.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2难度: 中等查看答案及解析
-
根据碘与氢气反应的热化学方程式,下列判断正确的是
①I2(g)+H2(g)⇌2HI(g)△H=-9.48kJ/mol
②I2(s)+H2(g)⇌2HI(g)△H=+26.48kJ/mol( )
A.254g I2(g)中通入2g H2(g),反应放热9.48 kJ
B.当反应②吸收52.96kJ热量时转移2mole-
C.反应②的反应物总能量比反应①的反应物总能量低
D.1 mol固态碘与1 mol气态碘所含能量相差17.00 kJ难度: 中等查看答案及解析
-
化学中常借助图象来表示某种变化过程,下列关于4个图象的说法正确的是( )
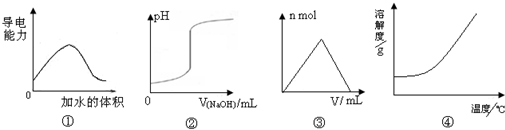
A.图①可表示t℃时,冰醋酸稀释过程中溶液导电性的变化
B.图②可表示向一定量盐酸中滴加一定浓度氢氧化钠溶液时,溶液pH的变化
C.图③可表示向一定量明矾溶液中滴加一定浓度氢氧化钡溶液时,产生沉淀的物质的量的变化
D.图④可表示所有的固体物质溶解度随温度的变化难度: 中等查看答案及解析
-
下列关于各装置图的叙述不正确的是( )
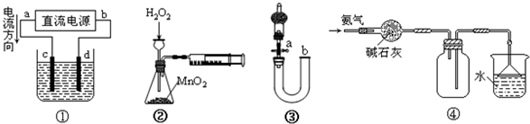
A.装置①中,c为阳极,d为阴极
B.装置②可定量测定H2O2的分解速率
C.关闭活塞a,从b处加水,可以检查装置③的气密性
D.装置④可用于收集并吸收多余的氨气难度: 中等查看答案及解析
-
某无色溶液可能含有①Na+ ②Ba2+ ③Cl一 ④Br一 ⑤SO32一 ⑥SO42一中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
下列结论正确的是( )步骤 操作 现象 (1) 向溶液中滴加氯水,再加入CCl4,振荡、静置 下层呈橙红色 (2) 分液,向水溶液中加入Ba(NO3)2溶液和稀HNO3 有白色沉淀产生 (3) 过滤,向滤液中加入AgNO3溶液和稀HNO3 有白色沉淀产生
A.肯定含有的离子是①④
B.肯定含有的离子是③④⑥
C.肯定没有的离子是②⑥
D.不能确定的离子是①③⑤难度: 中等查看答案及解析
-
A、B、C、X均为中学化学常见物质,一定条件下它们有如图转化关系(其它产物已略去),下列说法正确的是( )
A.若X为Fe,则C可能为Fe(NO3)2溶液
B.若X为KOH溶液;则A可能为A1
C.若A、B、C均为焰反应呈黄色的化合物,则X一定为CO2
D.若X为O2,则A可为有机物乙醇,也可为非金属单质硫难度: 中等查看答案及解析
-
下列说法正确的是( )
A.苯丙烯的同分异构体(包括顺反异构)共有5种
B.甲苯能使酸性高锰酸钾溶液褪色,而甲基环己烷不能,说明有机物分子中的基团间存在相互影响
C.芥子醇能发生氧化、取代、水解、加聚反应
D.将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热后有银镜生成,该物质不一定属于醛类.难度: 中等查看答案及解析

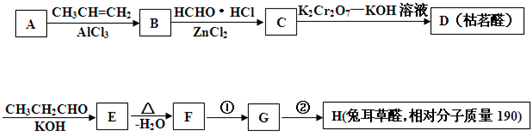
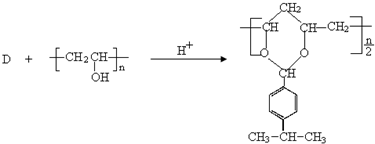
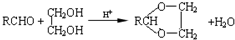
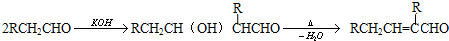
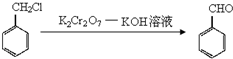
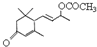 是否互为同分异构体________(填“是”或“否”),符合下列条件的
是否互为同分异构体________(填“是”或“否”),符合下列条件的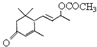 的同分异构体有________种,写出其中一种的结构简式________.
的同分异构体有________种,写出其中一种的结构简式________.