-
下列物质属于强电解质且该状态下能导电的是 ( )
(1)氯化钠溶液; (2)氯化铵固体; (3)铜; (4)石墨;(5)熔融NaOH; (6) 稀硫酸; (7)乙酸;
A.(1)(2)(5)(6) B.(5) C.(2)(5) D.(1)(3)(4)(5)(6)
难度: 中等查看答案及解析
-
下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤。正确的操作顺序是
A. ⑥③①②⑤④ B. ⑤①②⑥④③ C. ⑤④③②①⑥ D. ③①②④⑤⑥
难度: 中等查看答案及解析
-
某学生欲完成反应2HCl+2Ag== 2AgCl↓+H2↑而设计了下列四个实验,你认为可行的是

难度: 中等查看答案及解析
-
常温下,下列离子能使纯水中的H+离子数目增加的是 ( )
A.S2- B.CO32- C.NH4+ D.Br-
难度: 中等查看答案及解析
-
草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1 KHC2O4溶液中,下列关系正确的是
A.c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-)
B.c(HC2O4-)+c (C2O42-) = 0.1 mol·L-1
C.c(C2O42-) < c(H2C2O4)
D.c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-)
难度: 中等查看答案及解析
-
相同温度、相同浓度的溶液,pH值最小的是
A. NH4Cl B.NH4HCO3 C.NH4HSO4 D.(NH4)2 SO4
难度: 中等查看答案及解析
-
在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH
CH3COO-+H+ 对于该平衡,下列叙述正确的是
A.加入少量NaOH固体,平衡向逆反应方向移动
B.升高温度,平衡向正反应方向移动
C.加入水稀释,溶液中c(H+)一定增大
D.加入少量CH3COONa固体,平衡向正反应方向移动
难度: 中等查看答案及解析
-
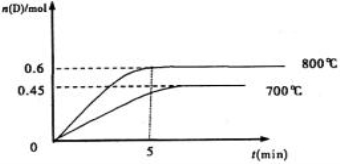
在298K、100kPa时,已知: ① 2H2O(g)=O2(g)+2H2(g) ΔH1
② Cl2(g)+H2(g)=2HCl(g) ΔH2 ③ 2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
A.Δ H3=ΔH1+2ΔH2 B.Δ H3=ΔH1+ΔH2
C.Δ H3=ΔH1-2ΔH2 D.Δ H3=ΔH1-ΔH2
难度: 中等查看答案及解析
-
在一定温度下,体积固定的密闭容器中,当下列物理量:①混合气体的压强 ② 气体的总物质的量 ③混合气体的密度 ④ B的物质的量浓度不再变化时,能表明可逆反应 A(s)+2B(g)
C(g)+D(g) 已达平衡的是 ( )
A.①② B. ③④ C. ①④ D. 只有④
难度: 中等查看答案及解析
-
某探究小组在某温度下测定溶液的pH时发现:0.01mol·L-1的NaOH溶液中,由水电离出的c(H+)·c(OH-)=10-22,则该小组在该温度下测得0.1mol·L-1NaOH溶液的pH应为
A.13 B.12 C.11 D.10
难度: 中等查看答案及解析
-
为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是
 A.正极的电极方程式为:O2+2H2O+4e-===4OH-
A.正极的电极方程式为:O2+2H2O+4e-===4OH-B.将石墨电极改成Mg电极,难以观察到铁锈生成
C.若向自来水中加入少量NaCl(s),可较快地看到铁锈
D.向铁电极附近吹入O2比向石墨电极附近吹入O2,铁锈出现得快
难度: 中等查看答案及解析
-
已知:(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H = + 74.9 kJ·mol-1,下列说法中正确的是
A.该反应中熵变、焓变皆大于0
B.该反应是吸热反应,因此一定不能自发进行
C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行
D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应
难度: 中等查看答案及解析
-
常温下,pH = 12的NaOH溶液与pH =1的HC1溶液按一定比例混合,所得溶液pH =2,则NaOH溶液与HC1溶液的体积比为
A.9:2 B.2:9 C.1:9 D.10:1
难度: 中等查看答案及解析
-
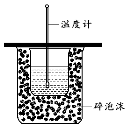
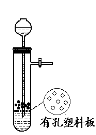
如图所示为实验室中完成不同的化学实验所选用的装置或进行的操作,其中没有明显错误的
A
测定中和热
B
用石灰石和稀盐酸制取CO2
C
蒸馏石油
D
配制溶液中转移溶液
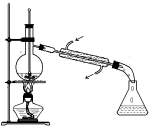
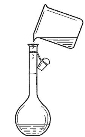
难度: 中等查看答案及解析
-
一定条件下,可逆反应:X(g) + 3Y(g)
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),反应达到平衡时, X、Y、Z的浓度分别为0.1mol•L-1、0.3 mol•L-1、0.08 mol•L-1, 则下列判断不正确的是 ( )
A.c1∶c2== 1∶3 B.平衡时,Y和Z生成速率之比为3∶2
C.X、Y的转化率不相等 D.c1的取值范围为0< c1< 0.14 mol•L-1
难度: 中等查看答案及解析
-
下列叙述正确的是
A.在原电池的正极和电解池的阳极上发生的都是氧化反应
B.实验室用惰性电极电解NaCl溶液,阴、阳两极收集到的气体体积之比为2∶1
C.用铜作电极电解稀硫酸,可能发生反应:Cu+H2SO4
CuSO4+H2↑
D.在用惰性电极电解稀硫酸的过程中,溶液pH保持不变
难度: 中等查看答案及解析
-
一定温度时,向饱和的BaSO4溶液中加水,下列叙述正确的是
A.BaSO4溶解度增大,Ksp不变 B.BaSO4溶解度、Ksp均增大
C.BaSO4溶解度不变,Ksp增大 D.BaSO4溶解度、Ksp均不变
难度: 中等查看答案及解析
-
体积相同的甲、乙两个容器中,分别充入等物质的量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g)
2SO3(g),并达到平衡,在此过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
A.等于p% B.大于p% C.小于p% D.无法比较
难度: 中等查看答案及解析
-
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是
A.由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-===AlO2-+2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-===Cu2+
D.由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗铜电极32 g
难度: 中等查看答案及解析
-
25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表,下列说法错误的是
物 质
X
Y
Z
初始浓度/mol·L-1
0.1
0.2
0
平衡浓度/mol·L-1
0.05
0.05
0.1
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
难度: 中等查看答案及解析