-
下列说法正确的是( )
A.用火焰上灼烧后闻气味和焰色反应等方法都可鉴别纤维素和蛋白质
B.1828年德国化学家武勒通过蒸发氰酸铵水溶液得到尿素,其意义在于找到了合成尿素的一种实用途径
C.道尔顿、汤姆生、卢瑟福和门捷列夫等对原子结构模型的建立作出了卓越的贡献
D.测定出土文物标本出14C在碳元素中原子数含量的减少程度,可推算文物的大致年代难度: 中等查看答案及解析
-
下列有关物质的性质及其解释都正确的是( )
A.在漂白粉中滴入70%的硫酸,立刻产生黄绿色气体,说明硫酸具有氧化性
B.不同的氨基酸在水溶液中形成晶体析出时pH各不相同,所以可以通过控制溶液pH的方法分离氨基酸
C.向一定体积的稀硝酸中加入过量的铜粉,生成的气体能被烧碱溶液完全吸收
D.在淀粉溶液中加入适量稀硫酸微热,再加少量新制氢氧化铜浊液加热,无红色沉淀,说明淀粉未水解难度: 中等查看答案及解析
-
如图实验为研究金属腐蚀的实验.下列相关说法正确的是( )
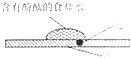
A.食盐水中有气泡逸出
B.铁表面的反应为Fe-3e→Fe3+
C.红色首先在食盐水滴的中心出现
D.该实验研究的是金属的吸氧腐蚀难度: 中等查看答案及解析
-
在铜催化和加热的条件下,用苯甲醇制得了苯甲醛,同时还有氢气生成.分离出铜后,检验所得苯甲醛是否为纯净物可用的方法是( )
A.测蒸气的摩尔体积
B.能否使酸性高锰酸钾溶液褪色
C.测熔点
D.能否发生银镜反应难度: 中等查看答案及解析
-
LiAlH4(
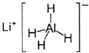 )、LiH是金属储氢材料,又是有机合成中的常用试剂,遇水均能剧烈反应释放出H2,LiAlH4在125℃分解为LiH、H2和Al.下列说法不正确的是( )
)、LiH是金属储氢材料,又是有机合成中的常用试剂,遇水均能剧烈反应释放出H2,LiAlH4在125℃分解为LiH、H2和Al.下列说法不正确的是( )
A.LiH与D2O反应,所得氢气的摩尔质量为4g•mol-1
B.1 mol LiAlH4在125℃完全分解,转移3 mol 电子
C.标准状况下,1 mol LiAlH4跟足量水反应可生成89.6L氢气
D.LiAlH4与乙醛反应可生成乙醇,其中LiAlH4作还原剂难度: 中等查看答案及解析
-
下表中的实验操作能达到实验目的或能得出相应结论的是( )
选项 实验操作 实验目的或结论 A 向盛有1mL 0.01mol•L-1 AgNO3溶液的试管中滴加0.01mol•L-1 NaCl溶液,至不再有沉淀生成,再向其中滴加0.01mol•L-1 NaI溶液,产生黄色沉淀. 常温下,
Ksp(AgCl)>Ksp(AgI)B C2H5Br与NaOH溶液混合充分震荡,在加入AgNO3溶液. 检验C2H5Br中溴元素 C 向某溶液中加硝酸银溶液产生 白色沉淀,再加稀硝酸沉淀消失 说明原溶液中一定含有NO2- D 向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液,红色褪尽 证明生成的气体全都是乙烯
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
棉籽中提取的棉酚是抗癌药品有效成分,市场价格相当于黄金价格的60倍.棉酚的结构可表示如下,下列有关说法不正确的是( )
A.棉酚可跟NaOH、FeCl3、Br2溶液反应
B.棉酚有较强的还原性,在空气中易被氧化
C.用1H核磁共振谱可证明棉酚分子中有9种氢原子
D.棉酚完全燃烧后只生成二氧化碳和水两种产物难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法正确的是( )
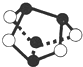
A.5.6g 铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA
B.常温常压下,1mol氦气含有的核外电子数为4NA
C.7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA
D.0.5mol雄黄(As4S4,结构如图)含有NA个S-S键难度: 中等查看答案及解析
-
二氧化硅(SiO2)又称硅石,是制备硅及其化合物的重要原料(如图).下列说法正确的是( )
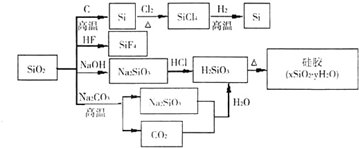
A.SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物
B.SiO2和Si都是光导纤维材料
C.在硅胶中加入CoCl2可显示硅胶吸水是否失效
D.图中所示转化反应都是非氧化还原反应难度: 中等查看答案及解析
-
W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,X的焰色呈黄色.W、Z最外层电子数相同,Z的核电荷数是W的2倍.工业上一般通过电解氧化物的方法获得Y的单质,则下列说法不正确的是( )
A.W、X、Y形成的简单离子核外电子数相同
B.Z和W可形成原子个数比为1:2和1:3的共价化合物
C.Y和Z形成的化合物可以通过复分解反应制得
D.X、Y和Z三种元素形成的最高价氧化物对应的水化物能两两反应难度: 中等查看答案及解析
-
下列各项表述中与示意图一致的是( )
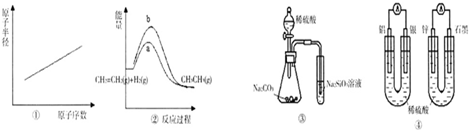
A.图①表示第三周期元素原子半径的变化规律
B.图②a、b曲线分别表示反应:CH2=CH2(g)+H2(g)→CH3CH3(g)△H>0,在使用和未使用催化剂时,反应过程中的能量变化
C.图③所示实验可比较硫、碳、硅三种元素的非金属性强弱
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同难度: 中等查看答案及解析
-
一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)=Z(g),经60s达到平衡,生成0.3mol Z.下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001mol/
B.将容器体积变为20L,Z的平衡浓度变为原来的
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则正反应的△H>0难度: 中等查看答案及解析
-
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如下图所示,则下列有关说法中不正确的是( )
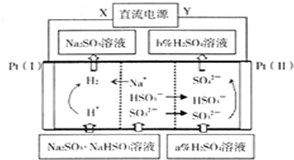
A.X为直流电源的负极,Y为直流电源的正极
B.图中的b>a
C.阳极区pH增大
D.该过程中的产品主要为H2SO4和H2难度: 中等查看答案及解析
-
下列实验现象所对应的离子方程式不正确的是( )
实验 现象 离子方程式 A K2SO4
Kl淀粉溶液在空气里放置一段时间后溶液呈蓝色 4H++4I-+O2═2I2+2H2O B 稀盐酸
稀碳酸钠溶液开始时无气泡,后来有气泡 CO +H+═HCO
HCO+H+═H2O+CO2↑
C NaOH溶液
Cl2水溶液由黄绿色变为无色 Cl2+2OH-═Cl-+ClO-+H2O D H2SO4加有酚酞的
Ba(OH)2溶液有白色沉淀生成,溶液由红色变为无色 Ba2++OH-+H++SO42-═BaSO4↓+H2O
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
为了研究一定浓度Fe2+的溶液在不同条件下被氧气氧化的氧化率,实验结果如下图所示,判断下列说法正确的是( )
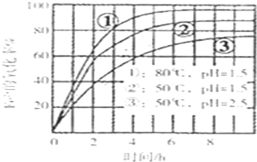
A.pH越小氧化率越大
B.温度越高氧化率越大
C.Fe2+的氧化率仅与溶液的pH和温度有关
D.实验说明降低pH、升高温度有利于提高Fe2+的氧化率难度: 中等查看答案及解析
-
常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的 pH如下表:
下列判断正确的是( )实验编号 c(HA)/mol•L-1 c(NaOH)/mol•L-1 混合溶液pH 甲 0.1 0.1 pH=a 乙 0.2 0.2 pH=9 丙 c1 0.2 pH=7 丁 0.2 0.1 pH<7
A.a>9
B.在乙组混合液中由水电离出的c(OH-)=10-5mol•L-1
C.c1=0.2
D.丁组混合液:c(Na+)>c(A-)>c(H+)>c(OH-)难度: 中等查看答案及解析
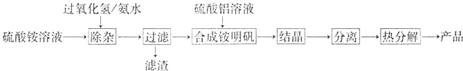
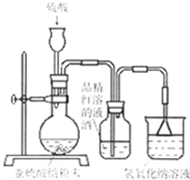
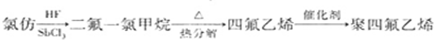
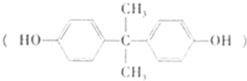
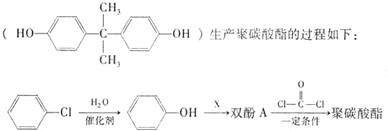
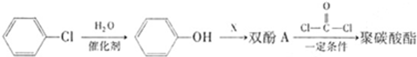
 ,反应类型为________;
,反应类型为________;