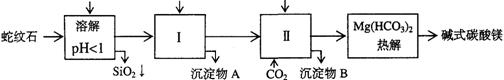
-
化学与科学、技术、社会、环境密切相关。下列有关说法中不正确的是
A.在我国上海举办的世博会采取了许多节能环保措施,充分利用太阳能是其中之一
B.在食盐中加入适量的碘酸钾,是因为碘酸钾具有较强的氧化性,可抗人体老化
C.2009年,中国水电装机容量、核电在建规模、太阳能热水器集热面积和太阳能光伏发电累计容量均居世界第一位
D.竹炭具有超强的吸附能力,能吸附新装修房屋内的有害气体
难度: 中等查看答案及解析
-
下列矿物的主要成分中,既含铁元素,又含铜元素的是
A.赤铁矿 B.孔雀石 C.黄铜矿 D.石灰石
难度: 中等查看答案及解析
-
下列有关物质用途的叙述中,不正确的是
A.硅可用作制造变压器的铁芯材料 B.石英玻璃可用于制造光学仪器
C.二氧化硅可用于制造光导纤维 D.水泥、玻璃、水晶饰物都是硅酸盐制品
难度: 中等查看答案及解析
-
某溶液中含有:①HCO3-、②SO32-、③CO32-、④NO3-等四种阴离子,向其中加入足量Na2O2固体后,假设溶液体积无变化,溶液中离子浓度基本保持不变的是
A.② B.②、③ C.①、④ D.④
难度: 中等查看答案及解析
-
“NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl”是著名的"侯氏制碱法"的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是
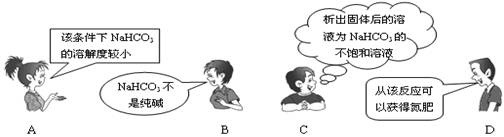
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法正确的是
A.78g Na2O2与足量水反应中电子转移了2NA
B.只有在标准状况下NA个氧气分子的物质的量才是1mol
C. 16g CH4中含有4 NA个C-H键
D.在铜与硫的反应中(生成硫化亚铜),1 mol铜失去的电子数为2NA
难度: 中等查看答案及解析
-
制印刷电路时常用氯化铁作腐蚀液,有关反应为2FeCl3 + Cu == 2FeCl2 + CuCl2。若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后不可能出现的情况是
A.有铜无铁 B.铁、铜都无 C.铁铜都有 D.有铁无铜
难度: 中等查看答案及解析
-
下列叙述正确的是
A.酸雨的形成主要是燃烧化石燃料引起的 B.氯气溶于水能导电说明氯气是电解质
C.能与酸、碱反应的物质都是两性化合物 D.金属与盐溶液的反应都是置换反应
难度: 中等查看答案及解析
-
半导体工业中,有一句行话:“从沙滩到用户”,即由SiO2制取Si。制取过程中不涉及的化学反应是

难度: 中等查看答案及解析
-
镁、铝、铜三种金属粉末的混合物,加入过量盐酸充分反应后,过滤,再向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子是
A.AlO2- B.Cu2+ C.Al3+ D.Mg2+
难度: 中等查看答案及解析
-
将mg Al2O3、Fe2O3的混和物溶解在过量的100mLpH值为1的硫酸中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好全部转化成沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为
A.0.1mol/L B.0.05mol/L C.0.2mol/L D.无法计算
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.向Mg(HCO3)2溶液中加入足量的澄清石灰水:
Mg2++2HCO3-+Ca2++2OH-=MgCO3↓+CaCO3↓+2H2O
B.Fe2O3溶于足量的氢碘酸中:Fe2O3+6H+=2Fe3++3H2O
C.向NH4A1(SO4)2溶液中滴人Ba(OH)2溶液恰好使SO42-沉淀完全
NH4++Al3++2SO42-+2Ba2++5OH-=AlO2—+NH3·H2O+2BaSO4↓+2H2O
D.用碳酸钠溶液吸收少量的二氧化硫:2CO32—+ SO2 + H2O =2HCO3—+SO32—
难度: 中等查看答案及解析
-
下列复分解反应一定不会有气体产生的是
A.盐与碱在水溶液中反应 B.盐与盐在水溶液中反应
C.酸与碱在水溶液中反应 D.盐与酸在水溶液中反应
难度: 中等查看答案及解析
-
向2mL 0.5mol/L的FeCl3溶液中加入3mL 3mol/L KF溶液,FeCl3溶液褪成无色,再加入KI溶液和CCl4振荡后静置,CCl4层不显色,则下列说法正确的是
A.Fe3+不与I-发生反应 B.Fe3+与F-结合成不与I-反应的物质
C.F-使I-的还原性减弱 D. Fe3+被F-还原为Fe2+,使溶液中不再存在Fe3+
难度: 中等查看答案及解析
-
大胆、科学的假设与猜想是科学探究的先导和价值所在。在下列假设(猜想)引导下的探究肯定没有意义的是
A.探究SO2和Na2O2反应可能有Na2SO4生成
B.探究Na与水的反应可能有O2生成
C.探究浓硫酸与铜在一定条件下反应产生的黑色物质中可能有CuS
D.探究向滴有酚酞试液的NaOH溶液中通Cl2时,酚酞红色褪去是溶液的酸碱性改变所致,还是HClO的漂白性所致
难度: 中等查看答案及解析
-
A是一种常见的单质,B、C为常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去)。下列说法中正确的是
A.X元素可能为铝
B.反应①和②互为可逆反应
C.X元素可能是金属,也可能是非金属
D.反应①和②一定为氧化还原反应
难度: 中等查看答案及解析
-
某混合气体G可能含有CO、CO2、SO2、H2O等气体,用a、无水CuSO4;b、澄清石灰水;c、灼热CuO;d、碱石灰;e、酸性品红溶液;f、酸性高锰酸钾溶液等药品可将其一一检出,则气体通过试剂的正确顺序是
A.G→a→e→b→f→d→c B.G→a→e→f→b→d→c
C.G→b→e→f→a→d→c D.G→c→d→b→e→f→a
难度: 中等查看答案及解析
-
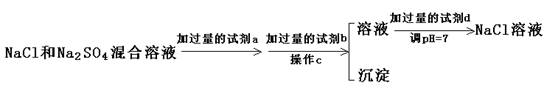
纯净的氯化钠是不潮解的,但粗盐很容易潮解,这主要是因为其中含有杂质MgCl2的缘故。为得到纯净的氯化钠,有人设计了一个实验:把买来的粗盐放入纯氯化钠饱和溶液一段时间,过滤,洗涤,可得纯净的氯化钠晶体。则下列说法中,正确的是
A.设计实验的根据是NaCl的溶解平衡
B.设计实验的根据是MgCl2比NaCl易溶于水
C.在整个过程中NaCl饱和溶液浓度会变大(温度不变)
D.粗盐的晶粒大一些有利于提纯
难度: 中等查看答案及解析
-
某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)
50mL盐酸
50mL盐酸
50mL盐酸
m(混合物)
9.2 g
13.8 g
27.6 g
V(CO2)(标况)
2.24 L
3.36 L
3.36 L
则下列分析推理中不正确的是
A.盐酸的物质的量浓度为3.0 mol/L
B.13.8g混合物恰好与盐酸完全反应
C.根据表中数据不能计算出混合物中NaHCO3的质量分数
D.加入混合物9.2 g时盐酸过量
难度: 中等查看答案及解析
-
某无色溶液中可能含有①Na+、②Ba2+、③Cl-、④Br-、⑤SO32-、⑥SO42-离子中的若干种,依顺序进行下列实验,且每步所加试剂均过量,观察到的现象如下:
步骤
操作
现象
1
用pH试纸检验
溶液的pH大于7
2
向溶液中滴加氯水,再加入CCl4振荡,静置
CCl4层呈橙色
3
向所得水溶液中加入Ba(NO3)2溶液和稀HNO3
有白色沉淀产生
4
过滤,向滤液中加入AgNO3溶液
有白色沉淀产生
下列结论正确的是
A.肯定含有的离子是①④⑤ B.肯定没有的离子是②⑥
C.不能确定的离子是① D.不能确定的离子是③⑤
难度: 中等查看答案及解析
-
用下图所示装置进行如下实验,能达到实验目的的是
A.瓶中盛满水,从B口进气,用排水法收集NO2
B.瓶中盛适量浓硫酸,从A口进气来干燥NH3
C.从B口进气,用排空气法收集CO2
D.瓶中装满水,A口连导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积
难度: 中等查看答案及解析
-
在复杂体系中,确认化学反应先后顺序有利于解决问题。下列反应先后顺序判断正确的是
A.在含等物质的量的AlO2—、OH—、CO32—溶液中,逐滴加入盐酸:AlO2—、Al(OH)3、OH—、CO32—
B.在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I—、Br—、Fe2+
C.在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2:KOH、Ba(OH)2、BaCO3
D.在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入Zn:Ag+、Cu2+、H+、Fe2+
难度: 中等查看答案及解析
-
等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是
A.甲、乙中都是铝过量 B. 甲中铝过量、乙中碱过量
C. 甲中酸过量、乙中铝过量 D. 甲中酸过量、乙中碱过量
难度: 中等查看答案及解析
-
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是
序号
甲
乙
丙
①
CO2
SO2
石灰水
②
HCl
CO2
石灰水
③
CO2
SO2
Ba(NO3)2
④
NO2
SO2
BaCl2
⑤
CO2
NH3
CaCl2
A.②③④ B.②③④⑤ C.①③④ D.①②③④
难度: 中等查看答案及解析
-
将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500mL2mol/LNaOH溶液完全吸收,生成的盐溶液中NaNO3的物质的量为(已知:2NO2+2NaOH=NaNO3+NaNO2+H2O;NO+NO2+2NaOH=2NaNO2+H2O)
A.0.2mol B.0.4mol C.0.6mol D.0.8mol
难度: 中等查看答案及解析