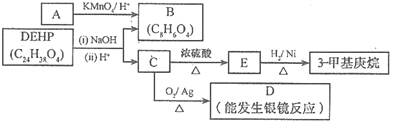
-
下列做法不正确的是( )
A.易燃试剂与强氧化性试剂分开放置并远离火源
B.用湿润的红色石蕊试纸检验氨气
C.在50 mL量筒中配制0.1000 mol•L-1碳酸钠溶液
D.金属钠着火时,用细沙覆盖灭火难度: 中等查看答案及解析
-
下列物质与水作用形成的溶液能与NH4Cl反应生成NH3的是( )
A.二氧化氮
B.钠
C.硫酸镁
D.二氧化硅难度: 中等查看答案及解析
-
下列关于有机物的叙述正确的是( )
A.乙醇不能发生取代反应
B.C4H10 有三种同分异构体
C.氨基酸、淀粉均属于高分子化合物
D.乙烯和甲烷可用溴的四氯化碳溶液鉴别难度: 中等查看答案及解析
-
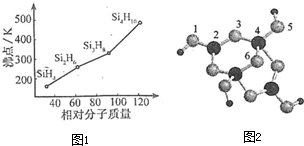
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中 T 所处的周期序数与族序数相等.下列判断不正确的是( )
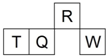
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.含 T 的盐溶液一定显酸性难度: 中等查看答案及解析
-
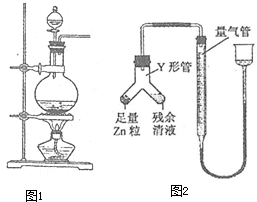
将如图所示实验装置的K闭合,下列判断正确的是( )
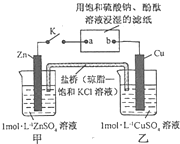
A.Cu 电极上发生还原反应
B.电子沿 Zn→a→b→Cu 路径流动
C.片刻后甲池中c(SO42-)增大
D.片刻后可观察到滤纸b点变红色难度: 中等查看答案及解析
-
下列说法正确的是( )
A.0.5molO3,与11.2 LO2所含的分子数一定相等
B.25℃与60℃时,水的pH相等
C.中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n ( Na0H)相等
D.2SO2(g)+O2(g)=2SO3 (g)和4SO2(g)+2O2(g)=4SO3 (g)的△H相等难度: 中等查看答案及解析
-
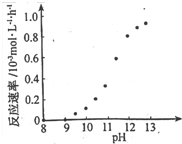
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是( )
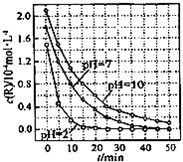
A.在0-50min之间,pH=2和pH=7 时R的降解百分率相等
B.溶液酸性越强,R 的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在 20-25min之间,pH=10 时 R 的平均降解速率为 0.04mol•L-1•min-1难度: 中等查看答案及解析