-
同温同压下,同体积的气体单质X2和气体单质Y2化合生成Z,其体积不变,则Z的化学式为
A.X2Y2 B.XY C.XY2 D.X2Y
-
下列变化过程中ΔH<0的是
A.Na与水反应
B.HCl分解为H2和Cl2
C.电解Al2O3得到Al和O2
D.Ba(OH)2·8H2O与NH4Cl晶体混合反应
-
对可逆反应4NH3(g) + 5O2(g)  4NO(g) + 6H2O(g),下列叙述正确的是
4NO(g) + 6H2O(g),下列叙述正确的是
A.化学反应速率关系是:2υ正(NH3) = 3υ正(H2O)
B.达到化学平衡时,4υ正(O2) = 5υ逆(NO)
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
-
下列说法或表示正确的是
A. 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B. 物质发生化学变化时一定伴随着放热现象
C. 稀溶液中:H+(aq)+OH﹣(aq)=H2O(l);△H=﹣57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含l mol NaOH的溶液混合,放出的热量大于57.3kJ
D. 在25℃101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ的热量,则H2燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l);△H=﹣285.8kJ/mol
-
在2A+B  3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A.v(A)=0.5 mol·L-1·s-1
B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1
D.v(D)=1.6 mol·L-1·min-1
-
沼气是一种能源,它的主要成分是CH4,0.5molCH4完全燃烧生成CO2和液态水时放出445kJ的热量,则下列热化学方程式中正确的是
A.2CH4(g)+4O2(g)=2CO2(g)+4H2O(g)△H=+890kJ•mol﹣1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890kJ•mol﹣1
C.1/2 CH4(g)+O2(g)=CO2(g)+H2O(l)△H=﹣890kJ•mol﹣1
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890kJ•mol﹣1
-
密闭容器中,用等物质的量A和B发生如下反应:A(g)+2B(g)  2C(g),反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为
2C(g),反应达到平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为
A.70% B.60% C.50% D.40%
-
分别向1 L 0.5 mol·L-1的NaOH溶液中加入①浓硫酸、②稀醋酸、③稀硝酸,恰好完全反应时的热效应分别为ΔH1、ΔH2、ΔH3,下列关系中正确的是
A.ΔH1>ΔH2>ΔH3
B.ΔH1<ΔH3<ΔH2
C.ΔH1>ΔH2=ΔH3
D.ΔH1=ΔH2<ΔH3
-
对于反应A(g)+2B(g)  2C(g),反应放热,下面各图能正确反映在这一反应中,反应时间t,温度T与平衡混合物中C的百分含量关系的是
2C(g),反应放热,下面各图能正确反映在这一反应中,反应时间t,温度T与平衡混合物中C的百分含量关系的是

-
已知热化学方程式:
H2O(g) = H2(g) + O2(g) △H = +241.8 kJ·mol-1
O2(g) △H = +241.8 kJ·mol-1
H2(g)+  O2(g) = H2O(1) △H = -285.8 kJ·mol-1
O2(g) = H2O(1) △H = -285.8 kJ·mol-1
当18g液态水变为水蒸气时,其热量变化是
A.吸热44 k J B.吸热88kJ C.放热44kJ D.吸热2.44 kJ
-
在一定温度下,反应A2(g)+B2(g)  2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
A.单位时间内生成n mol A2,同时生成n mol AB
B.容器内总压强不随时间改变
C.任何时间内A2、B2的物质的量之比为定值
D.单位时间内生成2n mol AB同时生成n mol B2
-
下图是可逆反应A+2B  2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断

A.降温后逆反应速率增大
B.逆反应是放热反应
C.若A、B是气体,则D是液体或固体
D.A、B、C、D均为气体
-
下列说法中正确的是
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应
C.反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0
D.ΔH的大小与热化学方程式的计量系数无关
-
下列叙述中,不能用平衡移动原理解释的是
A.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
B.高压比常压有利于合成SO3的反应
C.红棕色的NO2,加压后颜色先变深后变浅
D.黄绿色的氯水光照后颜色变浅
-
下列热化学方程式或离子方程式中,正确的是
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= -890.3kJ·mol-1
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)  2NH3(g) △H= -38.6kJ·mol-1
2NH3(g) △H= -38.6kJ·mol-1
C.氯化镁溶液与氨水反应: Mg2++2OH-=Mg(OH)2↓
D.氧化铝溶于NaOH溶液:Al2O3+2OH-=2AlO2-+H2O
-
右图是373K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是

A.该反应的热化学方程式为:N2+3H2 2NH3 △H=-92kJ·mol-1
2NH3 △H=-92kJ·mol-1
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热不变
D.在温度体积一定的条件下,通入1mol N2和3 mol H2反应后放出的热量为Q1kJ,若通入 2 mol N2和6mol H2反应后放出的热量为Q2kJ则184>Q2=2Q1
-
根据下图中的两个图象,选出符合题意的反应方程式

A.X+2Y Z
Z  >0
>0
B.X+2Y Z
Z  <0
<0
C.5X+3Y 4Z
4Z  <0
<0
D.X+2Y 3Z
3Z  <0
<0
-
一定条件下,可逆反应C(s)+CO2(g)  2CO(g) ΔH>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
2CO(g) ΔH>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是
A.①②③④ B.①③ C.①② D.①③④
-
已知:C(s)+ O2(g)===CO(g) ΔH=-110.5 kJ·mol-1①
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1①
C(s)+O2(g)===CO2(g) ΔH=-393.51 kJ·mol-1②
计算反应C(s)+CO2(g)===2CO(g)的反应热ΔH的值为
A.-283.01 kJ·mol-1
B.+172.51 kJ·mol-1
C.+283.1 kJ·mol-1
D.+504.00 kJ·mol-1
-
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在2 L固定容积的密闭容器中发生反应:2N2O5(g)  4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中,正确的是
4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中,正确的是
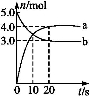
A.0~20 s内平均反应速率v(N2O5)=0.1 mol·(L·s)- 1
B.10 s时,正、逆反应速率相等,达到平衡
C.20 s时,正反应速率大于逆反应速率
D.曲线a表示NO2的物质的量随反应时间的变化