-
下列生活用品中主要由合成纤维制造的是
A. 尼龙绳 B. 宣纸 C. 羊绒衫 D. 棉衬衣
难度: 中等查看答案及解析
-
下列有关说法正确的是
A. 蛋白质和油脂都属于高分子化合物,一定条件下都能水解
B. 医疗上可用硫酸钡作x射线透视肠胃的内服药,是因为硫酸钡不溶于水
C. 用过滤的方法从碘的四氯化碳溶液中获得碘
D. 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法正确的是
A. 1mol乙烯分子中含有共用电子对数为6NA
B. 常温常压下,32gO2、O3的混合物含有Na个氧原子
C. 标准状况下,2.24 L CH2Cl2含有的分子数等于0.1 NA
D. 7.1 g C12与足量NaOH溶液反应转移0.2×6.02×1023个电子
难度: 简单查看答案及解析
-
已知放射性元素
位于元素周期表中第六周期第Ⅷ族,下列关于
的说法正确的是
A. 铱为非金属元素
B.
中子数与质子数的差为38
C. 铱元素与碘元素位于同一周期
D.
核外含有115个电子
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A. 铁与稀盐酸反应:2Fe+6H+===2Fe3++3H2↑
B. 在过氧化钠中加入稀硫酸:O22- +4H+===2H2O+O2↑
C. 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-===BaSO4↓
D. 澄清石灰水与过量的小苏打溶液反应:Ca2++2OH-+2HCO
===CaCO3↓+2H2O+ CO32-
难度: 中等查看答案及解析
-
元素X、Y、Z原子序数之和为37,X、Y在同一周期,X+与Z-具有相同的核外电子层结构。下列推测不正确的是
A. 同周期元素中X的金属性最强 B. 同族元素中Z的氢化物稳定性最高
C. 原子半径X>Y,离子半径X+>Z- D. 同周期元素中Y的最高价含氧酸的酸性最强
难度: 困难查看答案及解析
-
分子式为C3H6Cl2的有机物共有(不含立体异构)
A. 3种 B. 4种 C. 5种 D. 6种
难度: 中等查看答案及解析
-
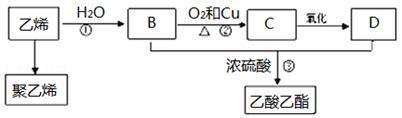
下列对相应有机物的描述完全正确的是
①甲烷:天然气的主要成分,能发生取代反应 ②乙烯:其产量是衡量一个国家石油化工发展水平的标志,可以发生加成反应 ③苯:平面结构,每个分子中含有3个碳碳双键 ④乙醇:可以用金属钠检验乙醇中是否含有水 ⑤淀粉:属于糖类物质,遇碘元素变蓝色⑥蛋白质:可通过烧焦的特殊气味进行鉴别,水解的最终产物为氨基酸.
A. ①②③ B. ②④⑥ C. ①⑤⑥ D. ①②⑥
难度: 中等查看答案及解析
-
工业上利用氢气在氯气中燃烧,所得产物再溶于水的方法制得盐酸,流程复杂且造成能量浪费。有人设想利用原电池原理直接制盐酸的同时,获取电能,假设这种想法可行,下列说法肯定错误的是
A. 通入氢气的电极为原电池的正极
B. 两极材料都用石墨,用稀盐酸做电解质溶液
C. 电解质溶液中的阳离子向通氯气的电极移动
D. 通氯气的电极反应式为Cl2+2e-=2Cl―
难度: 简单查看答案及解析
-
将 4 molA气体和3molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)
2C(g), 若经 2 s后测得 C的浓度为 0.6 mol•L-1,现有下列几种说法:
①用物质A 表示反应的平均速率为 0.3 mol•L-1•s-1
②物质 B的体积分数是40%
③2 s 时物质 A 的转化率为30%
④2 s 时物质 B 的浓度为 1.0 mol•L-1
其中正确的是
A. ①④ B. ②③ C. ①③ D. ③④
难度: 简单查看答案及解析
-
对于可逆反应4 NH3(g)+5O2(g)
4NO(g)+6 H2O(g),下列叙述正确的是
A. NH3和H2O化学反应速率关系是2v正(NH3)= 3v正(H2O)
B. 达到化学平衡时,4v正(O2)= 5v逆(NO )
C. 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D. 若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
难度: 困难查看答案及解析
-
某有机物的结构简式为
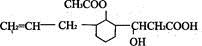 ,则此有机物可发生的反应类型有
,则此有机物可发生的反应类型有①取代 ②加成 ③氧化 ④酯化 ⑤中和
A. ①②③④ B. ②③④⑤ C. ②③⑤ D. ①②③④⑤
难度: 简单查看答案及解析
-
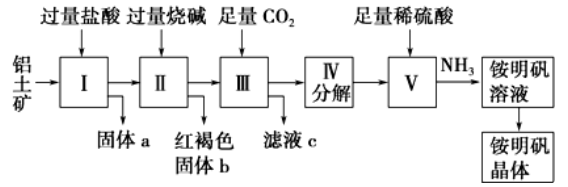
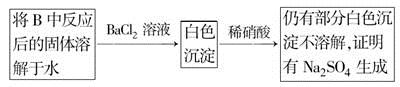
海洋中有丰富的食品、矿产、能源、药物和水产资源。下图是从海水中提取某些原料的。

下列有关说法正确的是
A. 第①步中除去粗盐中的SO、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液―→NaOH溶液―→BaCl2溶液―→过滤后加盐酸
B. 从第③步到第⑤步的目的是浓缩、富集溴
C. 第①到第⑤步中,涉及到氧化还原反应共有2步
D. 第④步中,SO2起氧化作用
难度: 简单查看答案及解析
-
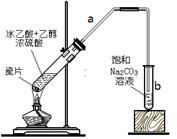
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤。下列图示装置和原理能达到实验目的的是( )
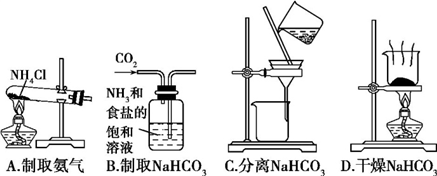
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
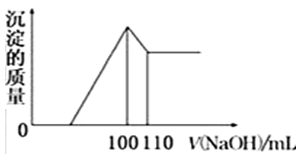
已知:还原性强弱:I->Fe2+。往100 mL碘化亚铁溶液中缓慢通入2.24 L(标准状况)氯气,反应完成后溶液中有一半的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为
A. 0.6 mol·L-1 B. 0.8 mol·L-1 C. 1.0 mol·L-1 D. 1.2 mol·L-1
难度: 简单查看答案及解析
-
将22.4 g 铁粉逐渐加入到含HNO3 0.8 mol的稀硝酸中,反应生成的气体的物质的量(x)随消耗铁粉的物质的量(y)变化关系中正确的是
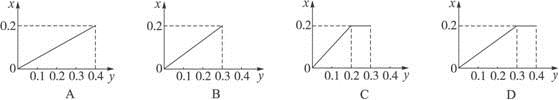
难度: 困难查看答案及解析