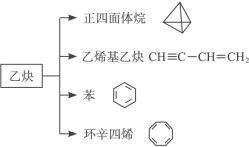
-
在多电子原子中,轨道能量是由以下哪些因素决定( )
①能层 ②能级 ③电子云的伸展方向 ④电子自旋状态
A. ①② B. ①④ C. ②③ D. ③④
难度: 简单查看答案及解析
-
原子结构模型经历了五个主要阶段:1803年实心球模型→1897年葡萄干面包式模型→1911年原子核式结构模型→1913 的轨道模型→20 世纪初电子云的原子结构模型。对轨道模型贡献最大的科学家是
A. 玻尔 B. 汤姆生 C. 卢瑟福 D. 道尔顿
难度: 简单查看答案及解析
-
常温下,1 mol化学键分解成气态原子所需要的能量用E表示。结合表中信息判断下列说法不正确的是
共价键
H—H
F—F
H—F
H—Cl
H—I
E/kJ·mol-1
436
157
568
432
298
A. 432 kJ·mol-1 > E(H—Br) > 298 kJ·mol-1
B. 表中最稳定的共价键是H—F键
C. H2(g)→2H(g) ΔH=+436 kJ·mol-1
D. H2(g)+F2(g) = 2HF(g) ΔH=-25 kJ·mol-1
难度: 中等查看答案及解析
-
人们常将在同一原子轨道上运动的,自旋状态相反的2个电子,称为“电子对”;将在同一原子轨道上运动的单个电子,称为“未成对电子”。以下有关主族元素原子的“未成对电子”的说法,正确的是( )
A. 核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子”
B. 核外电子数为偶数的基态原子,其原子轨道中一定不含“未成对电子”
C. 核外电子数为偶数的基态原子,其原子轨道中一定含有“未成对电子”
D. 核外电子数为奇数的基态原子,其原子轨道中可能不含“未成对电子”
难度: 中等查看答案及解析
-
下列有关原子核外电子排布规律,说法正确的是( )
A. 原子核外电子都是先排内层后排外层
B. Fe2+的价层电子排布式为3d54s1
C. 各原子轨道的伸展方向数按p、d、f的顺序分别为1、3、5
D. 同一原子中,1s、2s、3s能级最多容纳的电子数相同
难度: 简单查看答案及解析
-
下列电子层中,包含有f能级的是( )
A. K电子层 B. L电子层 C. M电子层 D. N电子层
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z是同周期中原子半径最大的元素,W的最高正价为+7价。下列说法正确的是( )
A. XH4的沸点比YH3高
B. X与W形成的化合物和Z与W形成的化合物的化学键类型相同
C. 元素W的最高价氧化物对应水化物的酸性比Y的弱
D. X与Y形成的化合物的熔点可能比金刚石高
难度: 中等查看答案及解析
-
已知某元素原子的L电子层上有6个电子,则该元素在周期表中位于( )
A. 第3周期IVA族 B. 第2周期VIA族
C. 第2周期IVA族 D. 第3周期VIA族
难度: 简单查看答案及解析
-
下列排列顺序错误的是( )
A. 酸性:H4SiO4<H3PO4<H2SO4<HClO4 B. 碱性:Ca(OH)2>Mg(OH)2>Al(OH)3
C. 原子半径:F<O<S<Na D. 氢化物的稳定性:SiH4>H2S>H2O>HF
难度: 简单查看答案及解析
-
按Li、Na、K、Rb、Cs顺序逐渐递增的性质是
A. 单质的还原性 B. 阳离子的氧化性
C. 单质的密度 D. 单质的熔点
难度: 中等查看答案及解析
-
下列能级能量由小到大排列顺序正确的是( )
A. 3s 3p 3d 4s B. 4s 4p 3d 4d
C. 4s 3d 4p 5s D. 1s 2s 3s 2p
难度: 简单查看答案及解析
-
根据电子排布的特点,Cu在周期表属于( )
A. ds区 B. p区 C. d 区 D. s区
难度: 简单查看答案及解析
-
下列说法中正确的是
A. 电子云图中的小黑点密表示该核外空间的电子多
B. 电子排布式 1s22s22px2违反了洪特规则
C. 原子序数为7、8、9的三种元素,其第一电离能和电负性均依次增大
D. 元素周期表中Fe处于ds区
难度: 简单查看答案及解析
-
下列说法中正确的是
A. NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8e-稳定结构;
B. P4和CH4都是正四面体分子且键角都为109o28ˊ;
C. CO2、SO2都是直线形的分子
D. CH2=CH2分子中共有五个σ键和一个π键
难度: 中等查看答案及解析
-
下列物质熔化时破坏分子间作用力的是( )
A. CaO B. CO2 C. SiO2 D. NaCl
难度: 简单查看答案及解析
-
根据下列性质判断所描述的物质可能属于分子晶体的是( )
A. 熔点1070℃,易溶于水,水溶液能导电
B. 熔点1128℃,沸点4446℃,硬度很大
C. 熔点10.31℃,液态不导电,水溶液能导电
D. 熔点97.81℃,质软,导电,密度0.97g/cm3
难度: 简单查看答案及解析
-
下列图象是从NaCl或CsCl晶体结构图中分割出来的部分结构图,试判断属于CsCl晶体结构的图象是( )
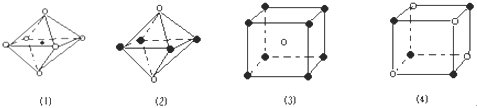
A. 图(1)和图(3) B. 只有图(3)
C. 图(2)和图(3) D. 图(1)和图(4)
难度: 中等查看答案及解析
-
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构与H2O2类似,熔点为193K,沸点为411K,遇水很容易水解,产生的气体能使品红褪色,S2Cl2可由干燥氯气通入熔融的硫中制得。下列有关说法正确的是
A. S2Cl2的电子式为
B. 固态时S2Cl2属于原子晶体
C. S2Cl2与NaOH的化学方程式可能为:S2Cl2+6NaOH=2NaCl+Na2SO3+Na2S+3H2O
D. S2Cl2是含有极性键和非极性键的离子化合物
难度: 中等查看答案及解析
-
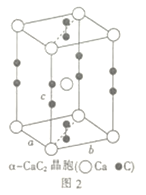
下列有关说法不正确的是
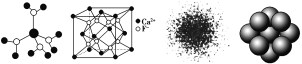
图1 图2 图3 图4
A. 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图3所示,H原子核外的大多数电子在原子核附近运动
D. 金属Cu原子堆积模型如图4所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
难度: 中等查看答案及解析
-
下列有关金属的说法正确的是( )
A. 金属原子的核外电子在金属晶体中都是自由电子
B. 金属导电的实质是金属阳离子在外电场作用下的定向移动
C. 金属原子在化学变化中失去的电子数越多,其还原性越强
D. 体心立方晶胞和面心立方晶胞中实际含有的原子个数之比为1:2
难度: 中等查看答案及解析
-
有一种星际分子,其分子结构模型如图所示(图中球与球之间的连线代表化学键,如单键、双键、
三键等,不同花纹的球表示不同的原子)。对该物质判断正确的是

A. ①处的化学键是碳碳双键 B. 该物质是烃的含氧衍生物
C. ③处的原子可能是氯原子或氟原子 D. ②处的化学键是碳碳单键
难度: 困难查看答案及解析
-
已知干冰晶胞结构属于面心立方最密堆积,晶胞中最近的相邻两个CO2 分子间距为apm,阿伏加德罗常数为NA,下列说法正确的是
A. 晶胞中一个CO2分子的配位数是8
B. 晶胞的密度表达式是
g/cm3
C. 一个晶胞中平均含6个CO2分子
D. CO2分子的空间构型是直线形,中心C原子的杂化类型是sp3杂化
难度: 困难查看答案及解析
-
下表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据。
元素
I1/eV
I2/eV
I3/eV
甲
5.7
47.4
71.8
乙
7.7
15.1
80.3
丙
13.0
23.9
40.0
丁
15.7
27.6
40.7
根据以上数据分析,下列说法正确的是
A. 甲的金属性比乙弱 B. 乙的化合价为+1价
C. 丙一定为非金属元素 D. 丁一定为金属元素
难度: 中等查看答案及解析
-
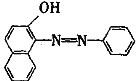
下列关于化合物A(结构简式如图)的叙述中正确的是
A. 分子中只有极性键
B. 该分子中三种元素的电负性:H>C>O
C. 分子中有σ键和兀键
D. 该分子在水中的溶解度小于甲烷的
难度: 中等查看答案及解析
-
有机锗具有抗肿瘤活性,锗元素的部分信息如右图。则下列说法不正确的是

A. x=2
B. 锗元素与碳元素位于同一族,属于ⅣA族
C. 锗位于元素周期表第4周期,原子半径大于碳的原子半径
D. 距离锗原子核较远区城内运动的电子能量较低
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 1s轨道的电子云形状为圆形的面
B. 2s的电子云半径比1s电子云半径大,说明2s能级的电子比1s的多
C. 电子在1s轨道上运动像地球围绕太阳旋转
D. 4f能级中最多可容纳14个电子
难度: 中等查看答案及解析

 )是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
)是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。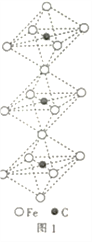

 。
。
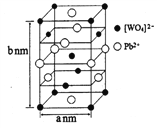
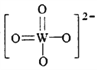 ,该离子中,σ键和π键的个数比是_____________。
,该离子中,σ键和π键的个数比是_____________。