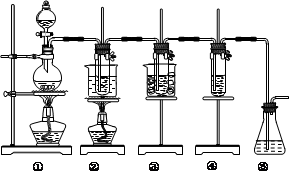
-
下列根据实验操作和现象所得出的结论正确的是
选项 实验操作 实验现象 结论
A 取等物质的量的两种金属单质X、Y,分别与足量的盐酸反应 X产生氢气的体积比Y多 金属性:X>Y
B 向滴有甲基橙的AgNO3溶液中滴加KCl溶液 溶液由红色变为黄色 KCl溶液具有碱性
C 在CuSO4溶液中加入KI溶液,再加入苯,振荡 有白色沉淀生成,苯层呈紫色 白色沉淀可能为CuI
D 取久置的Na2O2粉末,向其中滴加过量的盐酸 产生无色气体 Na2O2没有变质
难度: 中等查看答案及解析
-
对于0.1mol·L-1的Na2S溶液,下列判断正确的是 ( )
A.溶液中阴离子浓度的大小顺序:c(S2-)>c(OH-)>c(HS-)
B.c(Na+)=2c(S2-)+c(OH-)+c(HS-)
C.向Na2S溶液中加水稀释,其所有离子的浓度都减小
D.向溶液中加入少量NaOH固体,能促进水的电离
难度: 困难查看答案及解析
-
下列说法正确的是( )
A.植物油和矿物油都是酯,都可以作为有机溶剂
B.“酒是陈年香”是因为酒的保存过程中有酯生成
C.人的三大营养物质是糖、蛋白质与油脂,前两种是高分子化合物
D.蛋白质的盐析是可逆的,可用于精制蛋白质。所以,动物食用NaCl是不会中毒的
难度: 中等查看答案及解析
-
X、Y-、Z+三种微粒的电子层结构相同,则一定不能再相等的是( )。
A.中子数 B.质量数 C.电子数 D.核电荷数
难度: 中等查看答案及解析
-
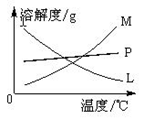
在t ℃时,向x g KNO3不饱和溶液中加入a g KNO3或蒸发掉b g水,恢复到t ℃,溶液均达到饱和,据此,下列推论不正确的是( )
A.在t ℃时,KNO3的溶解度为
g
B.若原溶液中溶质的质量分数为
,则x=2b
C.在t ℃时,所配的KNO3溶液中溶质的质量分数为w≤
%
D.若将原溶液蒸发掉2b g水,恢复到原温度析出2a g KNO3
难度: 困难查看答案及解析
-
下列各组物质,能用一种试剂鉴别的是( )
A.苯、己烯、甲苯 B.乙酸、乙醛、乙醇
C.乙醛、溴乙烷、硝基苯 D.苯酚、乙醇、甘油
难度: 中等查看答案及解析
-
下列反应属于氧化还原反应的是
A.H2SO4+2NaOH
Na2SO4+2H2O
B.MnO2+ 4HCl
MnCl2+ Cl2↑+ 2H2O
C.NH3 + HCl
NH4Cl
D.2NaHCO3
Na2CO3 + CO2↑ + H2O
难度: 简单查看答案及解析
-
在中和滴定中,中和一定量的某种醋酸溶液消耗NaOH ag,若先在该醋酸溶液中溶入少量CH3COONa,再用该NaOH中和,消耗该NaOH bg,则a与b的关系是( )
A.a>b B.a<b C.a=b D.无法确定
难度: 中等查看答案及解析
-
下列五种有机物:①甲烷 ②乙烯 ③乙炔 ④3-甲基戊烷 ⑤甲苯,某同学在分类时将①④⑤划为一类,②③划为一类。将①④⑤划为一类的依据是
A.①④⑤均为烃类物质
B.①④⑤均不能发生加成反应
C.①④⑤在光照下均能与Cl2发生取代反应
D.①④⑤均不能使酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法不正确的是 ( )
A.标准状况下,2.24 L O3所含有的电子数为2.4NA
B.含有NA个Na+的Na2O溶解于1L蒸馏水中,所得溶液中c(Na+)="l" mol/L
C.42 g乙烯和丙烯的混合气体中含有的碳原子数为3NA
D.25℃,l L纯水中含有的H+数为l×10-7NA
难度: 困难查看答案及解析
-
家庭住宅的窗玻璃大部分是普通玻璃,其成分是Na2SiO3·CaSiO3·6SiO2,在生产过程中加入不同的物质,调整玻璃的化学成分,可以制得具有不同性能和用途的玻璃。下表所列不正确的是
选项 A B C D
添加成分 Co2O3(氧化钴) Cu2O Fe2+ PbO
玻璃的色彩或性能 蓝色 红色 钢化玻璃 光学玻璃
难度: 简单查看答案及解析
-
做实验时不小心使皮肤上粘了一些高锰酸钾,形成的黑斑很久才能消除,如果用乙二酸的稀溶液洗涤,黑斑可以迅速褪去,其离子方程式为MnO4—+H2C2O4+H+→CO2↑+Mn2++ 。下列有关叙述正确的是( )
A.发生还原反应的是H2C2O4 B.该离子方程式右侧方框内的产物是OH—
C.10mol CO2生成时,电子转移5 mol D.1 mol乙二酸分子中含有7molσ键
难度: 困难查看答案及解析
-
下列反应的热化学方程式为:
(1)C(s)+O2(g)=CO2(g) ;ΔH 1=-393.5kJ/mol
(2)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ;ΔH 2=-870.3kJ/mol
(3)H2(g)+
O2(g)=H2O(l) ;ΔH 3=-285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的ΔH为( )
A.488.3 kJ/mol B.-488.3 kJ/mol C.-244.15 kJ/mol D.244.15 kJ/mol
难度: 中等查看答案及解析
-
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性是顺序为SO2 > I- > Fe2+ > H2O2> Cl-,则下列反应不可能发生的是( )
A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
B.I2+SO2+2H2O=H2SO4+2HI
C.2Fe2++I2=2Fe3++2I-
D.H2O2+SO2=H2SO4
难度: 中等查看答案及解析
-
可逆反应mA(s)+nB(g)
eC(g)+fD(g)在反应过程中,当其他条件不变时,C的体积分数
(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。下列叙述正确的是 ( )
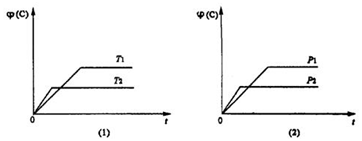
A.达到平衡后,若增大压强,混合气体的平均相对分子质量一定增大
B.当平衡后,若温度升高,化学平衡向逆反应方向移动
C.化学方程式中,n>e+f
D.达到平衡后,增加A,则B的转化率增大
难度: 困难查看答案及解析
-
大米久置后易霉变而产生黄曲霉毒素(AFTB),其分子结构式如右图所示,人体的特殊基因在黄曲霉素的作用下会发生突变,有转变为肝癌的可能。一般条件下跟1mol AFTB起反应的NaOH或H2的最大量分别是( )
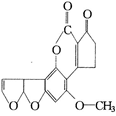
A.1mol;5mol B.1mol; 6mol
C.2mol;5mol D.2mol; 6mol
难度: 中等查看答案及解析
-
物质的量相同的下列溶液中,含微粒种类最多的是( )
A.CaCl2 B.CH3COONa C.NH4Cl D.Na2S
难度: 中等查看答案及解析
-
下面是几个不同价态的氮的化合物的相互转化关系(未配平),你认为一定不能实现的是( )
A.NO2+H2O→HNO3+NO B.NO+HNO3→N2O3+H2O
C.N2O4+H2O→HNO3+HNO2 D.NH3+NO→HNO2+H2O
难度: 中等查看答案及解析
-
下列说法正确的是
A.某酸H2A的钠盐NaHA溶液中:c(H2A)>c(A2-),则该溶液的pH>7
B.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2 c(Na+)=c(CH3COO-)
C.饱和Ca(OH)2溶液中加入一定量的生石灰,恢复至原来的温度,所得溶液的pH会增大
D.0.2 mol·L-1 NH4NO3和0.l mol·L-1 NaOH溶液等体积混合后:c(NH4+)>c(NO3-)>c(Na+)>c(OH-)>c(H+)
难度: 困难查看答案及解析
-
标准状况下有:①6.72LCH4②3.01×1023个HCl③10.8gH2O④0.7molNH3,下列对这四种气体的大小关系表示不正确的是( )
A.体积:④>③>②>① B.分子数:④>③>②>①
C.氢原子数:④>①=③>② D.质量:②>④>③>①
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.在0.1mol·L-1CH3COONa溶液中,c (OH-)==c(CH3COOH)+c(H+)
B.10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=10
C.0.1mol·L-1氨水中,c(OH-)==c(NH4+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)==2c(A2-)+c(HA-)+c(H2A)
难度: 困难查看答案及解析
-
在一定温度下,向2L体积固定的密闭容器中加入1molHI,2HI
H2(g)+I2(g)△H>0,H2的物质的量随时间的变化如图示,下列说法正确有是
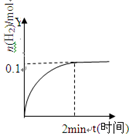
A.该温度下,反应的平衡常数是
B.0~2min内的HI的平均反应速率为0.05mol·L-1·min-1
C.恒压下向该体系中加入N2,平衡不移动,反应速率不变
D.升高温度,平衡向正反应方向移动,只有正反应速率加快
难度: 中等查看答案及解析
-
反应SiO2(s)+3C(s)=SiC(s)+2CO(g) △H>0的叙述中,正确的是
A.氧化剂是SiO2
B.氧化剂与还原剂的物质的量之比为1∶2
C.碳在反应中只做还原剂
D.若生成1molSiC转移电子为2mol
难度: 中等查看答案及解析