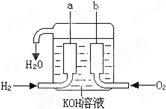
-
将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为( )
A.1:2:3
B.3:2:1
C..6:3:1
D.6:3:2难度: 中等查看答案及解析
-
热化学方程式中的化学计量数表示( )
A.分子个数
B.原子个数
C.物质的质量
D.物质的量难度: 中等查看答案及解析
-
1克H2燃烧生成液态水,放出142.9KJ热量,则表示该反应的热化学程式正确的是( )
A.H2(g)+O2(g)=H2O(1);△H=-285.8KJ/mol
B.2H2(g)+O2(g)=2H2O(1);△H=-142.9KJ/mol
C.2H2(g)+O2(g)=2H2O(g);△H=-571.6KJ/mol
D.2H2(g)+O2(g)=2H2O(1);△H=+571.6KJ/mol难度: 中等查看答案及解析
-
用石墨电极电解含有相同物质的量的Na2SO4和CuSO4的溶液.一段时间后,溶液颜色变浅.此时若要使溶液中的Na2SO4和CuSO4都恢复到电解前的浓度,应向电解后的溶液中加入适量的( )
A.H2O和CuO
B.CuO
C.Na2O和CuO
D.H2O和CuSO4难度: 中等查看答案及解析
-
以下现象与电化学腐蚀无关的是( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.用敷铜板和氯化铁溶液制作电路板难度: 中等查看答案及解析
-
如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
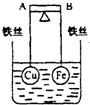
A.杠杆为导体和绝缘体时,均为A端高,B端低
B.杠杆为导体和绝缘体时,均为A端低,B端高
C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高难度: 中等查看答案及解析
-
反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g),在10L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率V(x)可表示为( )
A.V(NH3)=0.0010mol•L-1•S-1
B.V(O2)=0.0010 mol•L-1•S-1
C.V(NO)=0.010 mol•L-1•S-1
D.V(H2O)=0.045 mol•L-1•S-1难度: 中等查看答案及解析
-
将0.01mol相同颗粒大小的镁粉、铁粉分别加入到盛有50mL1mol•L-1硫酸的两烧杯甲和乙中,如图能正确反映实验结果的是
( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
下列变化过程中,△S<0的是( )
A.水蒸气凝结成水滴
B.硝酸铵固体溶于水
C.氮气和氧气混合
D.碳酸氢铵固体分解为NH3、H2O(g)和CO2难度: 中等查看答案及解析
-
可逆反应在2A(g)+3B(g)⇌3C(g)一定条件下,使一定量的A和B反应达到平衡状态时,下列说法正确的是( )
A.平衡混合物的体积是反应刚开始时的
B.平衡混合物中各物质的浓度比为2:3:3
C.单位时间内若消耗了a mol A,必须同时也消耗了1.5a mol的C
D.平衡混合物中各物质的浓度相等难度: 中等查看答案及解析
-
已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨)+O2(g)═CO2(g)△H=-393.51kJ•mol-1
C(金刚石)+O2(g)═CO2(g)△H=-395.41kJ•mol-1
据此判断,下列说法中正确的是( )
A.由石墨制备金刚石是吸热反应
B.由石墨制备金刚石是放热反应
C.石墨的能量比金刚石的低
D.石墨的能量比金刚石的高难度: 中等查看答案及解析
-
关于如图所示装置的说法正确的是( )
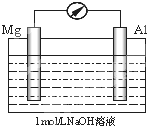
A.电流表指针将不会转动
B.外电路中电子流向是Al→Mg
C.Mg是负极,电极反应式为:Mg-2e-=Mg2+
D.Al是负极,电极反应式为Al+4OH--3e-=AlO2-+2H2O难度: 中等查看答案及解析
-
对于有气体参加的反应,下列措施均能加快反应速率,其中不是因为增大反应体系活化分子百分数而加快反应速率的是( )
A.缩小体积以增加反应体系的压强
B.保持体积不变,增大反应物的浓度
C.升高反应体系的温度
D.加入催化剂难度: 中等查看答案及解析
-
把镁条投入盛有稀盐酸的容器里,下列因素中,与产生氢气的速率有关系的是( )
A.盐酸的浓度
B.镁条的质量
C.温度
D.溶液中氯离子的浓度难度: 中等查看答案及解析