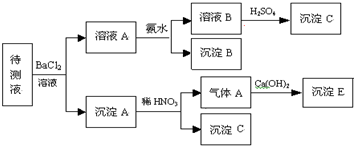
-
某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液(已知氯气和NaOH在一定温度下能发生反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O),经测定ClO-与ClO3-的物质的量之比为1:3,则氯气与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
A.21:5
B.11:3
C.3:1
D.4:1难度: 中等查看答案及解析
-
把xmLCO2通过足量的Na2O2后再与ymLNO混合.x与y之和为30mL.设充分反应后气体的体积缩小为15mL,则x:y为( )
①1:1 ②2:1 ③5:4 ④7:5.
A.只有①
B.只有②
C.只有③④
D.①②③④难度: 中等查看答案及解析
-
某白色固体可能由①NH4Cl②AlCl3③NaCl④AgNO3⑤KOH中的一种或几种组成,将此固体投入水中得到澄清溶液,该溶液可使酚酞呈红色.若向该溶液中加入稀硝酸至过量,有白色沉淀生成.对原固体组成的判断不正确 的是( )
A.可能存在②
B.至少有②⑤
C.无法确定是否有③
D.至少存在①④⑤难度: 中等查看答案及解析
-
制备氰氨基化钙的化学方程式为CaCO3+2HCN=CaCN2+CO↑+H2↑+CO2↑,在反应中( )
A.氢元素被氧化,碳元素被还原
B.HCN是氧化剂不是还原剂
C.CaCN2是氧化产物,H2是还原产物
D.CO为氧化产物,H2为还原产物难度: 中等查看答案及解析
-
下列各组物质中,因反应条件、用量、浓度等不同而发生不同化学反应的是( )
①C与O2 ②P与Cl2 ③Fe与S④Na与O2 ⑤CO2与NaOH溶液 ⑥Cu与硝酸 ⑦AgNO3溶液与氨水⑧AlCl3溶液与氨水 ⑨NaAlO2与盐酸 ⑩Na2CO3与盐酸.
A.除③⑨外
B.除③⑧外
C.除③⑦⑩外
D.除⑥⑦⑧外难度: 中等查看答案及解析
-
下列物质存放方法正确的是( )
A.药品柜的同一层不可同时存放浓硝酸和浓氨水
B.少量的钠保存在无水乙醇中
C.少量白磷保存在二硫化碳中
D.硅酸钠溶液保存在有玻璃塞的试剂瓶中难度: 中等查看答案及解析
-
下列各组溶液,不加任何试剂,也不做焰色反应实验,不能将其一一区别出来的是( )
A.(NH4)2SO4、BaCl2、NaOH、NaCl
B.NaCl、AgNO3、Na2CO3、CaCl2
C.CuSO4、BaCl2、NaOH、NaCl
D.Al2(SO4)3、Na2CO3、Ba(NO3)2、H2SO4难度: 中等查看答案及解析
-
下列各组离子在强碱性条件下能大量共存,而在强酸性条件下能发生氧化还原反应的是( )
A.Na+、K+、AlO2-、Cl-
B.K+、Na+、HCO3-、SO42-
C.Na+、K+、S2-、SO32-
D.Ca2+、Na+、I-、NO3-难度: 中等查看答案及解析
-
下列各组物质仅用水就能鉴别的是( )
①NO2和Br2蒸气 ②硝基苯和苯 ③固体NaOH和KNO3.
A.①②
B.②③
C.①③
D.①②③难度: 中等查看答案及解析
-
常温常压下,将下列各组气体分别充入到容积可变的密闭容器中,充分反应后,恢复到原来状况时体积由大到小的顺序是:①2mol NH3和1mol HCl,②2mol SO2和1mol O2,③2molH2S和1mol SO2,④2mol NO和1mol O2,⑤1mol H2S和1mol Cl2( )
A.②>④>⑤>①>③
B.②>⑤>④>①>③
C.④>②=⑤>③>①
D.④=⑤>②>③>①难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.向Ba(OH)2溶液与稀H2SO4溶液发生中和反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.H2S通入FeCl3溶液中:2Fe3++S2-=2Fe2++S↓
C.碳酸氢钠溶液与硫酸氢钠溶液反应:HCO3-+H+=CO2↑+H2O
D.向漂白粉溶液中通入SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO难度: 中等查看答案及解析
-
下列说法或表示方法中正确的是( )
A.等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多
B.氢气的燃烧热为285.8kJ•mol-1,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H=-285.8kJ•mol-1
C.Ba(OH)2•8H2O(s)+2NH4Cl(s)=BaCl2(s)+2NH3(g)+10H2O(l);△H<0
D.已知强酸强碱反应的中和热为57.3kJ•mol-1,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量要大于57.3kJ难度: 中等查看答案及解析
-
某君在实验室中观察到:(1)金属X不和1mol/L Y2+溶液反应;(2)金属Y可溶解在1mol/L Z2+溶液中,并析出金属Z;(3)金属Z不和1mol/L X2+溶液反应.据此判断三种金属还原性强弱的次序是( )
A.Y>X>Z
B.X>Z>Y
C.Y>Z>X
D.X>Y>Z难度: 中等查看答案及解析
-
将铁铝硅合金样品分等量两份分别与足量稀盐酸和烧碱充分反应放出氢气质量相同.合金中铁铝硅质量比不可能是( )
A.112:81:28
B.336:27:84
C.324:135:36
D.56:81:56难度: 中等查看答案及解析
-
若NA表示阿佛加德罗常数,下列说法不正确的是( )
A.60gSiO2中含Si-O键的个数为4NA
B.在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移2NA个电子
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
D.在相同的温度下,1L0.5mol•L-1NH4Cl溶液与2L0.25mol•L-1NH4Cl溶液中所含NH4+个数相同难度: 中等查看答案及解析
-
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的相对分子质量比乙的相对分子质量小
B.甲的摩尔体积比乙的摩尔体积小
C.甲中所含的原子数比乙中的所含的原子数少
D.甲中所含的分子数比乙中的所含的分子数少难度: 中等查看答案及解析
-
将2mol NaHCO3和一定量的Na2O2固体混合,在加热条件下让其充分反应后得到的固体,经测定Na2O2无剩余,则最后固体的物质的量为( )
A.1~2mol之间
B.1~4mol之间
C.2~4mol之间
D.大于4mol难度: 中等查看答案及解析
-
可用右图装置制取(必要时可加热)、净化、收集的气体是( )
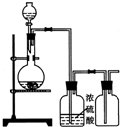
A.铜和稀硝酸制一氧化氮
B.氯化钠与浓硫酸制氯化氢
C.锌和稀硫酸制氢气
D.硫化亚铁与稀硫酸制硫化氢难度: 中等查看答案及解析
-
在标准状况下,4.48LSO2、CO2、H2的混合气体通入适量的饱和NaHCO3溶液中,充分反应后,若溶液中只有NaHSO3,逸出的气体中只有CO2和H2,且其质量之和为4.60g,则混合气体中SO2、CO2和H2的体积比可能为( )
A.1:1:1
B.1:1:2
C.1:2:2
D.1:2:3难度: 中等查看答案及解析
-
在一定温度下碳酸钠的溶解度为40g,向280g的饱和碳酸钠溶液中加入10.6g无水碳酸钠,搅拌静置,最终所得十水碳酸钠晶体的质量为( )
A.10.6g
B.60.6g
C.2.86g
D.89.2g难度: 中等查看答案及解析
-
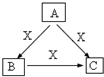
以下物质间的相互转化关系(如右图)中,A、B、C是常见的金属或非金属单质,D、E、F是常见的三种氧化物,常温下,D、E呈气态,F呈固态.下列推断正确的是( )
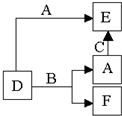
A.E和D中一定有A元素
B.A一定是金属单质
C.单质B肯定是氧化剂
D.C一定是氧气难度: 中等查看答案及解析
-
下图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量.下列反应对应的曲线错误的是( )
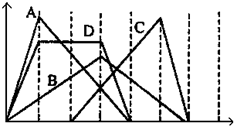
A.向NaAlO2溶液中滴入HCl至过量
B.向澄清石灰水中通入CO2至过量
C.向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量
D.向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失难度: 中等查看答案及解析
-
化合物A、B、C、D各由两种元素组成,甲、乙、丙是前两周期元素的三种单质.这些常见的化合物与单质之间存在如下关系(已知C是一种有机物),以下结论不正确的是( )
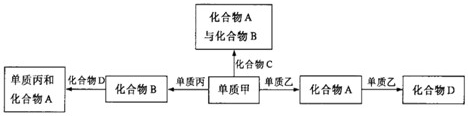
A.上图所示的五个转化关系中,有三个是化合反应
B.上述转化关系所涉及的化合物中有一种是电解质
C.甲、乙、丙三种单质的晶体一定是分子晶体
D.上图所示的五个转化关系中,均为氧化还原反应难度: 中等查看答案及解析
-
甲、乙是由短周期元素组成的常见物质或微粒,在中学化学中有许多物质或微粒能满足下列相互转化关系:甲
乙
甲下列说法正确的是( )
A.若乙为无色无味气体,则甲一定是CO32-
B.若甲是具有刺激性气味的气体,则甲、乙具有相同的电子数
C.若甲、乙均为离子,甲、乙两种离子在同一溶液中一定不能大量共存
D.甲有可能是AlO2-也有可能是Al(OH)3难度: 中等查看答案及解析
-
将质量为W1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L.向溶液中逐滴加入浓度为amol•L-1的HC1溶液,过程中有白色沉淀产生后又逐渐溶解,当沉淀恰好消失时所加HC1溶液体积为V2L.将溶液蒸干并充分灼烧得到固体W2g.下列关系式中错误的是( )
A.24n(A1)+35.5n(Na)=W2-W1
B.n(Na)+3n(A1)=aV2
C.n(Na)+3n(A1)=
D.aV2=难度: 中等查看答案及解析