-
电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是
A.原电池反应均是自发的氧化还原反应
B.氢氧燃料电池工作时氢气在正极被氧化
C.氢氧燃料电池是将热能转变为电能的装置
D.铅蓄电池在放电过程中,负极质量减小,正极质量增加
难度: 简单查看答案及解析
-
下列说法正确的是
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.任何能使熵值增大的过程都能自发进行
C.自发反应一定是熵增大,非自发反应一定是熵减小或不变
D.反应物和生成物所具有的总焓决定了反应是放热还是吸热
难度: 简单查看答案及解析
-
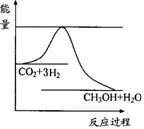
下列反应既是氧化还原反应,又是吸热反应的是
A.铝片与稀硫酸反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2反应 D.甲烷在O2中的燃烧
难度: 简单查看答案及解析
-
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
A.加热 B.加入硝酸钠固体
C.滴加少量CuSO4溶液 D.不用铁片,改用铁屑
难度: 简单查看答案及解析
-
在密闭容器中发生可逆反应4NH3+5O2
4NO+6H2O(g),以下是不同情况下的反应速率,其中最快的是
A.v(O2)=0.001mol/(L·S) B.v(NH3)=0.002 mol/(L·S)
C.v(H2O)=0.003 mol/(L·S) D.v(NO)=0.008 mol/(L·S)
难度: 简单查看答案及解析
-
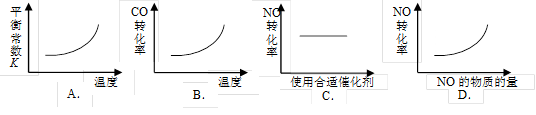
汽车尾气净化中的一个反应如下:
NO(g)+CO(g)
N2(g)+CO2(g) △H=-373.4kJ·mol-1
在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是
难度: 简单查看答案及解析
-
下列有关工业生产的叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
C.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
D.生铁浸泡在食盐水中发生吸氧腐蚀
难度: 简单查看答案及解析
-
有关热化学方程式书写与对应表述均正确的是
A.稀醋酸与0.1 mol/LNaOH溶液反应:H+(aq)+OH-(aq) = H2O(l) △H = -57.3kJ/mol
B.氢气的燃烧热为285.5 kJ/mol, 则水分解的热化学方程式:
2H2O(l)=2H2(g)+O2(g) △H = +285.5kJ/mol
C.密闭容器中,9.6 g硫粉与11. 2 g铁粉混合加热生成硫化亚铁17 .6 g时,放出19.12 kJ热量。 则Fe(s)+S(s)=FeS(s) △H= - 95.6KJ/mol
D.已知2C(s)+O2(g)=2CO(g) △H=-221 kJ/mol,则可知C的燃烧热为110.5 kJ/mol
难度: 简单查看答案及解析
-
在下列有FeCl3溶液参加的反应中,与Fe3+水解有关的反应是
①FeCl3溶液与Cu的反应 ②将FeCl3溶液加热蒸干,并灼烧最终得到Fe2O3 ③FeCl3溶液与KI的反应 ④饱和FeCl3溶液滴入沸水中制备Fe(OH)3胶体 ⑤FeCl3溶液与H2S的反应⑥FeCl3溶液与NaHCO3溶液的反应 ⑦配制FeCl3溶液需加入一定量的盐酸
A. ①④⑥ B. ②③⑤⑥ C。 ②④⑥⑦ D. ①②③④⑤⑥⑦
难度: 简单查看答案及解析
-
电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电解质的物质的量/原来总的物质的量)×100%。现取20 mL pH=3的 CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如右图,则加入氨水前CH3COOH的电离度为
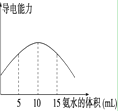
A.0.5% B.1.5% C.0.1% D.1%
难度: 简单查看答案及解析
-
单斜硫和正交硫转化为二氧化硫的能量变化图如右,下列说法正确的是
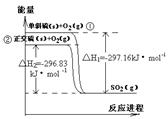
A.S(s,单斜) = S(s,正交) △H = +0.33kJ·mol -1
B.正交硫比单斜硫稳定
C.相同物质的量的正交硫比单斜硫所含有的能量高
D.①式表示断裂lmol O2中的共价键所吸收的能量比形成1mol SO2中的共价键所放出的能量少297.16kJ
难度: 简单查看答案及解析
-
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e一=4OH-
B.用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液的离子方程式为:
2C1-+2H2O
H2↑+Cl2↑+2OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu一2e-=Cu2+
D.钢铁发生电化学腐蚀的负极反应式:Fe一2e—=Fe2+
难度: 简单查看答案及解析
-
T℃时在1L密闭容器中A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图1所示;若保持 其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如图2所示。则下列结论正确的是
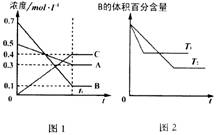
A.在达平衡后,保持其他条件不变,增大压强, 平衡向正反应方向移动
B.保持其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
C.在达平衡后,保持压强不变,通入稀有气体,平衡向正反应方向移动
D. T℃时,若由0.3mol·L –1A、0.1mol·L –1B、0.4mol·L –1C反应,达到平衡后,C的浓度为0.4mol·L –1
难度: 简单查看答案及解析
-
在密闭容器中,一定量混合气体发生下列反应: aM(g)+ bN(g)
cW(g),达一平衡后,测得M气体的浓度为0.5mol/L。当在恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是
A.反应速率增大 B.平衡向右移动
C.N的转化率提高 D.W的体积分数降低
难度: 简单查看答案及解析
-
某溶液中仅含Na+、H+、OH-、CH3COO-四种离子,下列说法错误的是
A.溶液中四种粒子之间不可能满足:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.若溶液中部分粒子间满足:c(CH3COO-)=c(Na+)则该溶液一定呈中性
C.若溶液中溶质仅为CH3COONa,则粒子间一定满足:
C(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.若溶液中的溶质为CH3COONa和CH3COOH,则溶液中粒子间一定满足:
C(CH3COO-)>c(Na+)>c(H+)>c(OH-)
难度: 简单查看答案及解析