-
吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用Na2SeO3清除人体内的活性氧,则Na2SeO3的作用是( )
A.还原剂 B.氧化剂 C.既是氧化剂又是还原剂 D.以上均不是
难度: 中等查看答案及解析
-
若NA表示阿伏加德罗常数,下列说法正确的是:( )
A.1mol H2O2含有极性共价键为NA,含有非极性键为2NA
B.2mol SO2和1mol O2在密闭容器中加热(V2O5催化)充分反应后,容器内分子总数为2NA
C.1molFeCl3完全转化为Fe(OH)3胶体后生成NA个胶粒
D.将0.1mol Cl2与足量NaOH溶液在常温下充分反应,转移的电子数为0.1NA
难度: 中等查看答案及解析
-
下列有关金属的说法中,正确的是( )
①在人类对金属材料的使用过程中,性质活泼的金属单质最早被人们冶炼和使用
②纯铁比生铁抗腐蚀性更强
③单质铝在空气中比较耐腐蚀,所以铝是不活泼金属
④正常人体缺钙会引起骨质疏松症,缺铁会引起贫血等疾病
⑤青铜、不锈钢、硬铝都是合金
⑥可通过焰色反应区分钾元素和钠元素
A.②④⑤⑥ B.②③④⑤ C.①③④⑤ D.①②⑤⑥
难度: 中等查看答案及解析
-
在周期表主族元素中,X元素位于第二周期,且分别与Y、Z、W三元素相邻,X、Y的原子序数之和等于Z的原子序数,这四种元素原子的最外层电子数之和为20。下列判断正确的是( )
A.原子序数:Z>Y>X>W
B.X、Y、Z、W形成的单质最多有6种
C.X元素最高价氧化物对应水化物的化学式为:H3 XO4
D.四种元素的气态氢化物中,W的气态氢化物最稳定
难度: 中等查看答案及解析
-
下列分子中属于含有极性键的非极性分子,且分子中各原子最外层都满足8电子稳定结构的是( )
A.CH4 B.PCl3 C.SiCl4 D.XeF4
难度: 中等查看答案及解析
-
某同学在实验室进行了如图所示的实验,下列说法中错误的是( )

A.利用过滤的方法,可将Z中固体与液体分离
B.X、Z烧杯中分散质相同
C.Y中反应的离子方程式为:3CaCO3+2Fe3++3H2O====2Fe(OH)3+3CO2↑+3Ca2+
D.Z中分散系能产生丁达尔效应
难度: 中等查看答案及解析
-
查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为:
CH3CH2OH-2e-→X+2H+。下列说法中正确的是( )
A.电池内部H+由正极向负极移动
B.另一极的电极反应式为:O2 + 4e- + 2H2O = 4OH-
C.乙醇在正极发生反应,电子经过外电路流向负极
D.电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O
难度: 中等查看答案及解析
-
将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
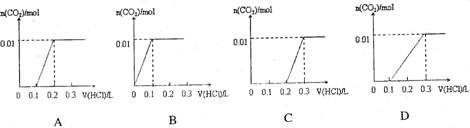
难度: 中等查看答案及解析
-
将17.9gAl、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生气体3.36L(标准状况)。另取等质量的合金溶于过量的稀硝酸中,生成6.72L NO(标准状况,唯一还原产物),向反应后的溶液中加入过量的NaOH溶液,得到沉淀的质量为( )
A.33.2g B.25.4g C.22.4g D.19.6g
难度: 中等查看答案及解析
-
为贮存、运输、使用的方便,工业上常将H2O2转化为固态的过碳酸钠晶体(其化学式为2Na2CO3•3H2O2),该晶体具有Na2CO3和H2O2的双重性质。下列物质不会使过碳酸钠晶体较快失效的是( )
A.MnO2 B.H2S C.稀硫酸 D.NaHCO3
难度: 中等查看答案及解析
-
有一瓶Na2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀。对此实验下述结论正确的是( )
A.Na2SO3已部分被空气中的氧气氧化
B.加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4
C.此实验不能确定Na2SO3是否部分被氧化
D.加硝酸后的不溶沉淀一定是BaSO3
难度: 中等查看答案及解析
-
下列离子方程式正确的是 ( )
A. 向盐酸中滴加氨水:H+ + OH- = H2O
B. Fe(OH)3溶于氢碘酸:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
C. 铜溶于稀硝酸:3Cu + 8H+ + 2NO3- = 3Cu2+ + 2 NO ↑+ 4H2O
D. 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+
难度: 中等查看答案及解析
-
SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F 、S-F键需吸收的能量分别为160kJ、330kJ。则S(s)+3F2(g)=SF6(g)的反应热ΔH为( )
A.-1780kJ/mol B.-1220 kJ/mol C.-450 kJ/mol D.+430 kJ/mol
难度: 中等查看答案及解析
-
亚氨基羟(Li2NH)是一种储氢容量大,安全性好的固体储氢材料,其储氢原理可表示为
Li2NH+H2=LiNH2+LiH。下列有关说法正确的是( )
A. Li2NH中N的化合价是-1 B.该反应中H2既是氧化剂又是还原剂
C.Li+和H+的离子半径相等 D.此法储氢和钢瓶储氢的原理相同
难度: 中等查看答案及解析
-
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右下图所示。

常温下,S2Cl2遇水易水解,并产生能使品红褪色的气体。下列说法错误的是( )
A.S2Cl2与H2O反应的化学方程式可能为: 2S2Cl2+2H2O=SO2↑+3S↓+4HCl
B.S2Cl2为含有极性键和非极性键的极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.
难度: 中等查看答案及解析