-
(11分) 已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:
请回答以下问题:
电解时,粗铜应与电源的________极相连。阴极上的电极反应式为________。
电解过程中,硫酸铜的浓度会________(选填:变大、不变、变小)。
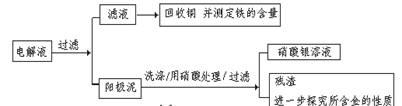
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:________。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 | 反应 | 平衡常数 |
| 1 | Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O | << 1 |
| 2 | Au3+ + 4Cl— = AuCl4— | >>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因:________。
(2)滤液含量的测定:
以下是该小组探究滤液的一个实验流程:

则100mL滤液中Cu2+ 的浓度为________mol·L—1 ,Fe2+的浓度为mol·L—1
-
(8分)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。步骤一:电解精制:
请回答以下问题:电解时,阴极上的电极反应式为________;
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:________。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 | 反应 | 平衡常数 |
| 1 | Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O | << 1 |
| 2 | Au3+ + 4Cl— = AuCl4— | >>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因:________
(2)滤液含量的测定: 以下是该小组探究滤液的一个实验流程:

则100ml滤液中Fe2+的浓度为________mol·L-1
-
(10分)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:
请回答以下问题:
电解时,粗铜应与电源的________极相连。阴极上的电极反应式为________
电解过程中,硫酸铜的浓度会________(选填:变大、不变、变小)
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:________
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 | 反应 | 平衡常数 |
| 1 | Au + 6HNO3(浓) Au(NO3)3 + 3NO2↑+ 3H2O Au(NO3)3 + 3NO2↑+ 3H2O | << 1 |
| 2 | Au3+ + 4Cl— AuCl4— AuCl4— | >>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因:________
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程:

则100mL滤液中Cu2+ 的浓度为________mol·L-1 ,Fe2+的浓度为________mol·L-1
-
(14分)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(杂质与酸不反应)。某化学兴趣小组在实验室条件下以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:
电解时,粗铜应与电源的▲ _极相连,阴极上的电极反应式为▲ 。
电解过程中,硫酸铜的浓度会▲ (选填:变大、不变、变小)。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:▲ 。残渣含有极少量的黄金。为了回收金,他们查阅了有关资料(见下表):
| 序号 | 反应 | 化学平衡常数 |
| 1 | Au + 6HNO3(浓) Au(NO3)3 + 3NO2↑+ 3H2O Au(NO3)3 + 3NO2↑+ 3H2O | << 1 |
| 2 | Au3+ + 4Cl- = AuCl4- | >>1 |
从资料中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你从化学平衡移动的角度简要解释金能够溶于王水的原因▲ 。
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程:

则100mL滤液中Cu2+ 的浓度为▲ mol·L-1 ,Fe2+的浓度为▲ mol·L-1
-
(8分)[化学—化学与技术]
粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。在实验室条件下以硫酸铜溶液为电解液,用电解的方法对粗铜提纯,并对阳极泥和电解液中金属进行回收和含量测定。回答以下问题;
(1)步骤一:电解精制:电解过程中,硫酸铜的浓度会________(选填:变大、不变、变小)。
步骤二:电解完成后,对电解液进行处理。
(2)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式:________。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 | 反应 | 平衡常数 |
| 1 | Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O | << 1 |
| 2 | Au3+ + 4Cl— = AuCl4— | >>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比l:3的混合物).请你简要解释金能够溶于王水的原因________。
(3)电解液含量的测定:下图是该小组探究电解液的一个实验流程:

则100mL滤液中Cu2+ 的浓度为________mol·L—1 ,Fe2+的浓度为________mol·L—1
-
粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应).在实验室条件下以硫酸铜溶液为电解液,用电解的方法对粗铜提纯,并对阳极泥和电解液中金属进行回收和含量测定.
回答以下问题:
步骤一:电解精制:电解过程中,硫酸铜的浓度会______(选填:变大、不变、变小).
步骤二:电解完成后,对电解液进行处理:
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式:______.
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 | 反应 | 平衡常数 |
| 1 | Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O | <<1 |
| 2 | Au3++4Cl-=AuCl4- | >>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1:3的混合物),请你简要解释金能够溶于王水的原因:______.
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程:

则100mL滤液中Cu2+ 的浓度为______mol•L-1,Fe2+的浓度为______mol•L-1.
-
粗铜中含有少量的锌、铁、银、金等金属。某化学兴趣小组以硫酸铜为电解液电解精炼铜之后,将电解液过滤得到滤液A和阳极泥。该小组同学设计如下实验方案测定滤液A中Fe2+ 、Cu2+ 的浓度。
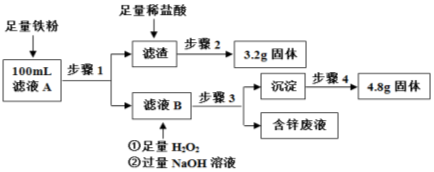
已知:Zn(OH)2可与NaOH反应生成溶于水的Na2ZnO2。
试回答下列问题:
(1)步骤2中涉及的操作是________、洗涤、晾干、称量;步骤4的操作依次是洗涤、灼烧、冷却、称量,在灼烧时,除需要三脚架外,还需要用到的实验仪器是____________(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯
B.坩埚
C.表面皿
D.泥三角
E.酒精灯
F.干燥器
(2)写出滤液B中加入H2O2 发生反应的离子方程式_________________________________
(3)滤液A中c(Cu2+)=_______mol•L-1 ,c(Fe2+)=_______mol•L-1 ;若步骤4的操作中“灼烧”不够充分,则滤液A中c(Fe2+)_____________(填偏大“偏大”、“偏小”或“无影响”)。
-
(15分) 某校化学兴趣小组为了探究粗铁粒(含有少量金属铜杂质)与某浓度硝酸反应,设计了如下探究活动:
探究一
(1)将粗铁粒投入某浓度硝酸中,某同学观察该实验现象时发现,反应进行一段时间后,反应开始逐渐加快。请分析反应逐渐加快的可能原因
_______________________________________________________________________。
(2)另称取粗铁粒10 g放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y。为了探究溶液X中铁元素的价态,同学甲设计如下实验:有药品和仪器:0.1 mol·L-1 KSCN溶液;0.1 mol·L-1 KI溶液;0.2 mol·L-1酸性高锰酸钾溶液;氯水等;试管和滴管
请你设计简单实验,探究上述猜想是否正确,填写下列实验报告:
| 实验步骤 | 现象 | 结论 | 离子方程式 |
| 第一步 | 取2-3 mL溶液装于试管,向试管中加入几滴KSCN溶液。 | | |
| 第二步 | | 若溶液紫色褪去,则溶液含有Fe2+; 若无明显变化,则不含Fe3+。 | |
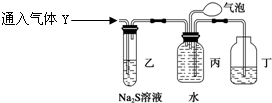
探究二 为了探究气体Y的成分,同学乙设计了如下装置(不考虑NO2转化为N2O4)
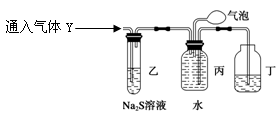
(3)装置乙的作用:。
(4)装置丙收集到满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定
气体Y中含NO? 说明理由。
________________________________________________________________________。
(5) 同学丁为了探究气体Y的组成,将224mL气体Y通入足量的NaOH溶液中,气体被完全吸收,所得溶液再用0.15 mol·L-1酸性KMnO4溶液滴定,消耗20 mLKMnO4溶液。
则气体Y中NO、NO2的体积比为________。
(已知2NO2+2NaOH=NaNO3+NaNO2+H2O和NO2+NO+2NaOH=2NaNO2+H2O)
-
某校化学兴趣小组为了探究粗铁粒(含有少量金属铜杂质)与某浓度硝酸反应,设计了如下探究活动:
探究一
(1)将粗铁粒投入某浓度硝酸中,某同学观察该实验现象时发现,反应进行一段时间后,反应开始逐渐加快。请分析反应逐渐加快的可能原因①_____________②_____________。
(2)另称取粗铁粒10 g放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y。为了探究溶液X中铁元素的价态,甲同学设计如下实验:
有药品和仪器:0.1mol/L KSCN溶液、0.1mol/L KI溶液、0.2mol/L酸性高锰酸钾溶液、氯水等,试管和滴管。
请你设计简单实验,探究上述猜想是否正确,填写下列实验报告:
| 实验步骤 | 现象 | 结论 | 离子方程式 |
| 第一步 | 取2~3 mL溶液装于试管,向试管中加入几滴KSCN溶液。 | | |
| 第二步 | | 若溶液紫色褪去,则溶液含有Fe2+;若无明显变化,则不含Fe3+。 | |
探究二
为了探究气体Y的成分,同学乙设计了如下装置(不考虑NO2转化为N2O4)
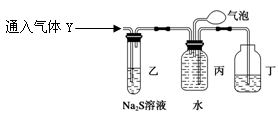
(3)装置乙的作用: ________。
(4)装置丙收集满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定气体Y中含NO?说明理由____________。
(5)同学丁为了探究气体Y的组成,在标准状况下将224mL气体Y通入足量的NaOH溶液中,气体被完全吸收,所得溶液再用0.1500mol/L酸性KMnO4溶液滴定,消耗20.00mLKMnO4溶液。则气体Y中NO、NO2的体积比为 ________ 。(已知2NO2+2NaOH=NaNO3+NaNO2+H2O和NO2+NO+2NaOH=2NaNO2+H2O)
-
某校化学兴趣小组为了探究粗铁粒(含有少量金属铜杂质)与某浓度硝酸反应,设计了如下探究活动:
探究一
(1)将粗铁粒投入某浓度硝酸中,某同学观察该实验现象时发现,反应进行一段时间后,反应开始逐渐加快.请分析反应逐渐加快的可能原因______.
(2)另称取粗铁粒10g放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y.为了探究溶液X中铁元素的价态,同学甲设计如下实验:有药品和仪器:0.1mol•L-1 KSCN溶液;0.1mol•L-1 KI溶液;0.2mol•L-1酸性高锰酸钾溶液;氯水等;试管和滴管
请你设计简单实验,探究上述猜想是否正确,填写下列实验报告:
| 实验步骤 | 现象 | 结论 | 离子方程式 |
| 第一步 | 取2-3mL溶液装于试管,向试管中加入几滴KSCN溶液. | ______ | ______ |
| 第二步 | ______ | 若溶液紫色褪去,则溶液含有Fe2+;
若无明显变化,则不含Fe3+. | ______ |
探究二 为了探究气体Y的成分,同学乙设计了如下装置(不考虑NO2转化为N2O4)
(3)装置乙的作用:______.
(4)装置丙收集到满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定气体Y中含NO?说明理由.______.
(5)同学丁为了探究气体Y的组成,将224mL气体Y通入足量的NaOH溶液中,气体被完全吸收,所得溶液再用0.15mol•L-1酸性KMnO4溶液滴定,消耗20mL KMnO4溶液.则气体Y中NO、NO2的体积比为______.(已知2NO2+2NaOH=NaNO3+NaNO2+H2O和NO2+NO+2NaOH=2NaNO2+H2O)