-
下列各组分子中,均含有非极性键且属于非极性分子的是 ( )
A.C2H2NH3 B.Cl2 C2H4
C.CO2H2S D.NH3 H2O2
难度: 中等查看答案及解析
-
下列晶体中既含有离子键又含有极性共价键和配位键的是 ( )
A.NaCl B.H2SO4 C.NH4Cl D.Na2O2
难度: 中等查看答案及解析
-
向下例配合物的水溶液中加入AgNO3溶液,不能生成AgCl沉淀的是( )
A.[Co(NH3)5Cl]Cl2 B.[Co(NH3)6]Cl3
C.[Co(NH3)3Cl3] D.[Co(NH3)4Cl2]Cl
难度: 中等查看答案及解析
-
现有四种元素的基态原子的核外电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3④1s22s22p5
则下列有关比较中正确的是 ( )
A.第一电离能:④>③>②>① B.原子半径:④>③>②>①
C.电负性:④>③>②>① D.最高正化合价:④>③=②>①
难度: 中等查看答案及解析
-
X、Y、Z、W为四种短周期元素,有关这四种元素的说法中一定正确的是( )
元素
X
Y
Z
W
原子半径(nm)
0.077
0.075
0.102
0.099
最高正价或最低负价
+4
+5
-2
-1
A.1molW的单质参加氧化还原反应时转移的电子数为2mol
B. X与Z形成XZ2时各原子均满足8电子稳定结构
C.0.3molCu分别与足量HYO3和H2ZO4的稀溶液反应均产生0.2mol气体
D.Y的氢化物与W的氢化物反应的产物只含有共价键
难度: 困难查看答案及解析
-
解释下列物质性质的变化规律与物质结构间的因果关系时,与氢键有关的变化规律是( )
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.熔点:Li> Na> K> Rb
C.NaF、NaCl、NaBr、NaI的熔点依次降低
D.H2S的熔沸点小于H2O的熔沸点
难度: 中等查看答案及解析
-
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cs+离子核间距为a cm,氯化铯的摩尔质量为M,NA为 阿伏加德罗常数,则氯化铯晶体的密度为( )
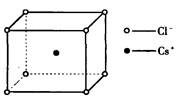
A.
B.
C.
D.
难度: 中等查看答案及解析
-
实现下列变化时,需克服相同类型作用力的是 ( )
A.金刚石和干冰的熔化 B.食盐和烧碱的熔化
C.液溴和液汞的气化 D.氨的气化和水的电离
难度: 简单查看答案及解析
-
下列物质固态时一定是分子晶体的是( )
A.酸性氧化物 B.碱性氧化物 C.含氧酸 D.非金属单质
难度: 中等查看答案及解析
-
下列关于晶体的说法一定正确的是( )
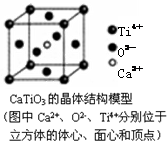
A.分子晶体中都存在共价键
B.CaTiO3晶体中每个Ti4+和12个O2-相紧邻
C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D.熔融时化学键没有破坏的晶体一定是金属晶体
难度: 中等查看答案及解析
-
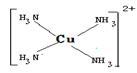
向盛有硫酸铜水溶液的试管里加入少量氨水,开始生成浅蓝色的碱式硫酸铜沉淀[Cu2(OH)2SO4],继续加入足量氨水时,沉淀溶解得到深蓝色的铜氨溶液,若在该溶液中加入乙醇,即得到深蓝色晶体[Cu(NH3)4]SO4?H2O。下列说法不正确的是 ( )
A.在[Cu(NH3)4]2+离子中,Cu2+给出空轨道,NH3提供孤对电子
B.生成了深蓝色的[Cu(NH3)4]2+,[Cu(NH3)4]SO4在乙醇中的溶解度较小
C.碱式硫酸铜与氨水反应的离子方程式
Cu2(OH)2SO4 + 8NH3?H2O = 2[Cu(NH3)4]2+ + SO42- + 2OH- + 8H2O
D.深蓝色晶体中只含有离子键、配位键和氢键
难度: 困难查看答案及解析
-
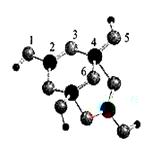
化学反应可视为旧键断裂和新键生成的过程。键能是形成(拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下键能(kJ· mol-1): P-P:198, P-O:360,O-O:498,则化学反应P4(白磷)+3O2=P4O6的反应热△H为 ( )
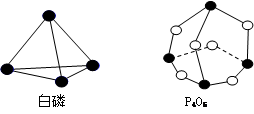
A.-1638 kJ·mol-1 B.+1638 kJ·mol-1
C.-126 kJ·mol-1 D.+126kJ·mol-1
难度: 中等查看答案及解析
-
中学化学中很多规律都有其使用范围,下列根据有关“规律”推出的结论合理的是( )
A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
B.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO
C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性
D.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7
难度: 中等查看答案及解析
-
近年来,科学家合成了一系列具有独特化学特性的氢铝化合 物(AlH3)n。已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高。Al2H6球棍模型如下图。下列有关说法肯定错误的是( )
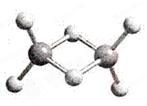
A.Al2H6在固态时所形成的晶体是分子晶体
B.氢铝化合物可能成为未来的储氢材料和火箭燃料
C.Al2H6中含有离子键和极性共价键
D.Al2H6在空气中完全燃烧,产物为氧化铝和水
难度: 中等查看答案及解析
-
北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子晶体,具有良好的超导性。下列有关分析正确的是( )
A.K3C60中只有离子键 B.K3C60中碳元素显-3价
C.C60与12C互为同素异形体 D.该晶体在熔融状态下能导电
难度: 中等查看答案及解析
-
通常把原子总数和价电子总数相同的分子或离子称为等电子体。人们发现等电子体的空间结构相同,则下列有关说法中正确的是 ( )
A.BF3和
是等电子体,均为平面正三角形结构
B.B3N3H6和苯是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道
C.NH3和PCl3是等电子体,均为三角锥形结构
D.CH4和
是等电子体,键角均为60°
难度: 中等查看答案及解析