-
下列对沉淀溶解平衡的描述正确的是( )
A.电解质的溶解开始后,只有电解质的溶解过程,没有电解质的析出过程
B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等
C.沉淀溶解达到平衡时,溶液中溶质的各离子浓度相等,且保持不变
D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解
难度: 简单查看答案及解析
-
在氨水中存在 NH3·H2O
NH4+ +OH-的平衡,如果使平衡向 逆 反应方向移动,同时使c(OH-)增大,应加入 ( )
A.氯化铵固体 B.硫酸 C.NaOH固体 D.大量水
难度: 简单查看答案及解析
-
已知BaCO3和BaSO4均为难溶电解质,其溶度积分别为Ksp(BaCO3)=5.1×10-9 mol2·L-2,Ksp(BaSO4)=1.1×10-10 mol2·L-2,则下列说法中正确的是( )
A.BaSO4可做钡餐而BaCO3不能是因为Ksp(BaSO4)<Ksp(BaCO3)
B.在制腈纶纤维的1 L溶液中含SO42-为1.0×10-3 mol,则加入0.01 mol BaCl2不能使SO42-完全沉淀
C.在清理有关仪器的BaSO4沉淀时,常加入饱和Na2CO3溶液,使BaSO4转化为BaCO3再用酸处理
D.用稀H2SO4洗涤BaSO4效果比用水好,BaCO3也能用此法处理
难度: 简单查看答案及解析
-
在室温下等体积的酸和碱的溶液,混合后pH一定小于7的是 ( )
A. pH=3的硝酸跟pH=11的氢氧化钾溶液 B. pH=3的盐酸跟pH=11的氨水溶液
C. pH=3的硫酸跟pH=11的氢氧化钠溶液 D. pH=3的醋酸跟pH=11的氢氧化钡溶液
难度: 简单查看答案及解析
-
pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=11,则强碱与强酸的体积比是 A.11∶1 B.9∶1 C.1∶11 D.1∶9
难度: 简单查看答案及解析
-
使20mLNaOH溶液和20mL氨水分别与0.1mol/L的盐酸反应,若反应完全时,都消耗盐酸20mL,则原来的NaOH溶液和氨水
A 电离程度相同 B pH值相同 C 物质的量浓度相同 D c(OH-)相同
难度: 简单查看答案及解析
-
在加入铝粉能产生H2的溶液中下列各组离子可能大量共存的是( )
A.NH4+ NO3- CO32- Na+ B.Na+ Ba2+ Mg2+ HCO3-
C.NO3- Mg2+ K+ Cl- D.NO3- K+ AlO2- OH-
难度: 简单查看答案及解析
-
向体积为0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是
A. Va>Vb时:c(CH3COOH) +c(CH3COO-)>c(K+)
B. Va=Vb时:c(CH3COOH) +c(H+)>c(OH-)
C. Va<Vb时:c(CH3COO-)> (K+)>c(OH-)> c(H)
D. Va与Vb任意比时:c(K+)+ c(H+) = c(OH-)+ c(CH3COO-)
难度: 简单查看答案及解析
-
要使0.1mol/L CH3COOH溶液中CH3COOH的电离程度减小,同时又使CH3COO-浓度增大;可加入的试剂是
A、CH3COONa晶体 B、氨水 C、0.1mol/L H2SO4溶液 D、0.01mol/L CH3COOH溶液
难度: 简单查看答案及解析
-
在相同的温度时100mL0.01mol·L-1的醋酸溶液与10mL0.1mol·L-1醋酸溶液相比较,下列数值前者大于后者的是
A、中和时所需氢氧化钠的物质的量 B、H+浓度
C、H+的物质的量 D、CH3COOH的物质的量
难度: 简单查看答案及解析
-
下列表述正确的是
A.0.1mol·L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
B.0.1mol·L-1CH3COONa溶液中:c(Na+)=c(CH3COO-)+c(OH-)
C.浓度均为0.1mol·L-1的CH3COONa、NaOH和Na2CO3三种溶液的pH大小顺序:
pH(NaOH)>pH(Na2CO3)>pH(CH3COONa)
D.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至中性,溶液中离子浓度的关系:
c(CH3COO-)>c(Na+)>c(OH-)=c(H+)
难度: 简单查看答案及解析
-
关于下列装置说法正确的是
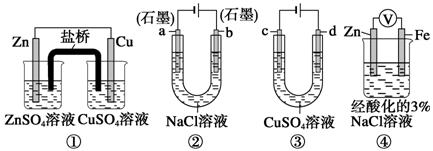
A.装置①中,盐桥中的K+移向ZnSO4溶液
B.用装置③精炼铜时,c极为粗铜
C.装置②工作一段时间后,a极附近溶液的pH增大
D.装置④中电子由Zn流向Fe,装置中有Fe2+生成
难度: 简单查看答案及解析
-
某学生欲完成2HCl+Cu===CuCl2+H2↑反应,设计了如图所示的四个实验,你认为可行的实验是( )
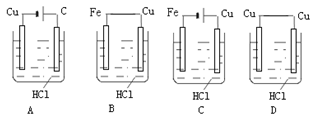
难度: 简单查看答案及解析
-
有关如图装置的叙述不正确的是( )
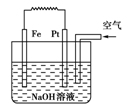
A.这是电解NaOH溶液的装置
B.该装置中Pt为正极,电极反应为O2+2H2O+4e-=4OH-
C.该装置中Fe为负极,电极反应为Fe+2OH-=Fe(OH)2+2e-
D.这是一个原电池装置
难度: 简单查看答案及解析
-
醋酸溶液中存在电离平衡:CH3COOH
H++CH3COO-,下列叙述不正确的是( )
A.CH3COOH溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.0.1 mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
难度: 简单查看答案及解析
-
铅蓄电池的工作原理为Pb+PbO2+2H2SO4====2PbSO4+2H2O,研读下图,下列判断不正确的
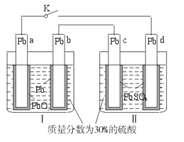
A.K闭合时,d电极反应式:PbSO4+2H2O-2e- ====PbO2+4H++
B.当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol
C.K闭合时,Ⅱ中
向c电极迁移
D.K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极
难度: 简单查看答案及解析
-
某酸式盐NaHY的水溶液显碱性,下列叙述正确的是( )
A.H2Y的电离方程式:H2Y
2H++Y2-
B.HY-的水解方程式:HY-+H2O
H3O++Y2-
C.该酸式盐溶液中离子浓度关系:c(Na+)> c(HY-)> c(OH-)> c(H+)
D.该酸式盐溶液中离子浓度关系:c(Na+)> c(Y2-)> c(HY-)> c(OH-)> c(H+)
难度: 简单查看答案及解析
-
有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液各25 mL,物质的量浓度均为0.1 mol/L,下列说法正确的是( )
A.3种溶液pH的大小顺序是③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25 mL 0.1 mol·L-1的盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
难度: 简单查看答案及解析
-
现有pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 L,其pH与溶液体积的关系如图所示,下列说法正确的是( )
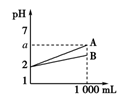
①A是强酸或比B强的弱酸,B是弱酸 ②稀释后,A溶液的酸性比B溶液强 ③若A、B均为弱酸,则2<a<5 ④若A、B均为强酸,则A、B的物质的量浓度一定相等.
A.①② B.①③ C.①③④ D.②③④
难度: 简单查看答案及解析
-
以惰性电极电解CuSO4溶液。若阳极上 产生气体的物质的量为0.010 mol,则阴极上析出Cu的质量为
A.0.64 g B.5.12 g C.2.56 g D. 1.28 g
难度: 简单查看答案及解析
-
按下图装置实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示
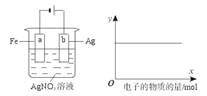
①c(Ag+) ②c(AgNO3) ③a棒的质量 ④b棒的质量 ⑤溶液的pH
A.①③ B.③④ C.①②④ D.①②⑤
难度: 简单查看答案及解析
-
在25mL 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是
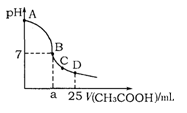
A.在A、B间任一点(不含A、B点),溶液中一定有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-) >c(OH-)=c(H+)
C.在C点,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点,c(CH3COO-)+c(CH3COOH)=c(Na+)
难度: 简单查看答案及解析

