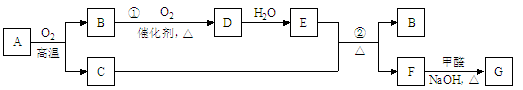
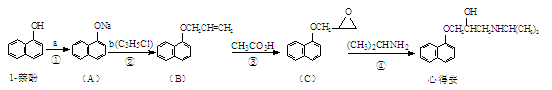
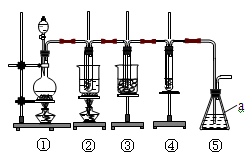
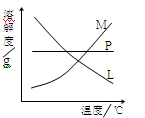
-
化学已渗透到人类生活的各个方面。下列说法正确的是
A.氧化亚铁能与酸反应,可用于制作红色涂料
B.在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀
C.碘是人体必需的微量元素,所以要多吃富含高碘酸的食物
D.维生素C是水溶性维生素,能增强人体抵抗力,有解毒作用
难度: 中等查看答案及解析
-
下列说法正确的是
A.依据丁达尔现象可将分散系分为溶液、胶体与浊液
B.用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率
C.制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸
D.实验室从海带提取单质碘的方法是:
难度: 中等查看答案及解析
-
以下有关原子结构及元素周期律的叙述中正确的是
A.同种元素的原子均有相同的质子数和中子数
B.同主族元素的简单阴离子还原性越强,水解程度越大
C.同周期金属元素的化合价越高,其原子失电子能力越强
D.短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是
A.pH = a的氨水溶液,稀释10倍后,其pH = b,则a = b + 1
B.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成
C.在Na2C2O4稀溶液中,c(OH-) = c(H+) + c(HC2O4—) + 2c(H2C2O(4)
D.0.1 mol/L Na2CO3溶液与0.1 mol/L NaHCO3溶液等体积混合:3c(Na+) = 2[c(CO32—) + c(HCO3—) + c(H2CO(3)]
难度: 困难查看答案及解析
-
下列操作不能达到实验目的的是
选项
实 验 目 的
实 验 操作
A
在溶液中将MnO4—完全转化为Mn2+
向酸性KMnO4溶液中滴加H2O2溶液至紫色消失
B
验证Br2的氧化性强于I2
将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色
C
检验Fe(NO3)2晶体是否已氧化变质
将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红
D
验证Fe(OH)3的溶解度小于Mg(OH)2
将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色
难度: 困难查看答案及解析