-
下列各组物质全部是弱电解质的是
A.H2O、NH3·H2O、H3PO4、HF B.Cu(OH)2、CH3COOH、C2H5OH、CH3COONa
C.H2SO3、Ba(OH)2、BaSO4 D.SO2、H2S、CO2
难度: 简单查看答案及解析
-
化学平衡常数(K)电离常数(Ka、Kb)、溶度积常数(Ksp)等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是
A.当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)均变大
B.Ka(HCN)<Ka(CH3COOH)说明相同物质的量浓度时,氢氰酸的酸性比醋酸的强
C.向氯化钡溶液中加入等体积同浓度的碳酸钠和硫酸钠溶液,先产生BaSO4沉淀,则Ksp(BaSO4)>Ksp(BaCO3)
D.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
难度: 中等查看答案及解析
-
加热下列物质的稀溶液,可能使离子总数减小的是(不考虑溶液的挥发)
A.Fe2(SO4)3 B.CH3COOH C.NaOH D.Ca(HCO3)2
难度: 中等查看答案及解析
-
同温度下的四种溶液,当NH4+浓度相同时,溶液的物质的量浓度最大的是
A.NH4Al(SO4)2 B.NH4Cl C.NH3·H2O D.CH3COONH4
难度: 简单查看答案及解析
-
下列有关溶液组成的描述合理的是
A.无色溶液中可能大量存在Al3+、NH4+、Cl-、S2-
B.酸性溶液中可能大量存在Na+、ClO-、SO42-、I-
C.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3-
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO42-
难度: 中等查看答案及解析
-
对于常温下pH=2的醋酸溶液,下列叙述正确的是
A.c(H+)=c(CH3COO-)
B.加水稀释时
增大
C.与pH = 12的NaOH溶液等体积混合后,溶液呈中性
D.加入醋酸钠固体可抑制醋酸的电离,电离常数Ka变小
难度: 中等查看答案及解析
-
下列关于电解质溶液的叙述正确的
A.室温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为 c(Cl-)>c(NH4+)>c(H+)=c(OH-)
B.将PH=4的醋酸溶液稀释后溶液中所有离子浓度均降低
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.室温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
难度: 中等查看答案及解析
-
25℃时,浓度均为0.2 mo1/L的NaHCO3与Na2CO3溶液中,下列判断不正确的是
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大
难度: 简单查看答案及解析
-
常温下,0.1 mol·L-1的某一元酸(HA)溶液中
=1×10-8,下列叙述正确的是
A.该一元酸溶液的pH=1
B.该溶液中水电离出的c(H+)=1×10-11mol•L-1
C.该溶液中水的离子积常数为1×1022
D.用 pH=11的NaOH 溶液 V1 L 与V2 L 0.1 mol·L-1该一元酸(HA)溶液混合,若混合溶液的pH=7,则V1<V2
难度: 简单查看答案及解析
-
常温下用pH为3的某酸溶液分别与pH都为11的氨水、氢氧化钠溶液等体积混合得到a、b两种溶液,关于这两种溶液酸碱性的描述正确的是
①b不可能显碱性 ②a可能显酸性或碱性
③a不可能显酸性 ④b可能显碱性或酸性
A.①② B.③④ C.①③ D.②④
难度: 简单查看答案及解析
-
实验室用标准盐酸测定某NaOH溶液的浓度,用甲基橙作指示剂,下列对测定结果评价错误的是
选项
操作
测定结果评价
A
酸式滴定管用蒸馏水洗涤后未用标准盐酸润洗2~3次
偏高
B
开始实验时,酸式滴定管尖嘴部份有气泡,在滴定过程中气泡消失
偏高
C
锥形瓶未干燥
无影响
D
盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
偏低
难度: 中等查看答案及解析
-
某温度下,相同体积相同pH的盐酸和醋酸分别加水稀释,pH随溶液体积变化的曲线如图所示。下列判断正确的是
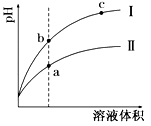
A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点KW的数值比c点KW的数值大
D.b点酸的总浓度大于a点酸的总浓度
难度: 简单查看答案及解析
-
下列关于0.10mol·L-1NaHCO3溶液的说法正确的是
A.溶质的电离方程式为NaHCO3═Na++H++CO32-
B.25℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
D.温度升高,c(HCO3-)增大
难度: 简单查看答案及解析
-
在K2CrO4溶液中存在着如下平衡2CrO42-+ 2H+
Cr2O72-+ H2O, K=1×1014。若用0.05mol K2Cr2O7配制成1LK2CrO4溶液,其中c(Cr2O72-)<10-5mol/L,则所配溶液的pH
A.>7 B.<7 C.=7 D.无法确定
难度: 简单查看答案及解析
-
室温下,在0.2 mol·L-1Al2(SO4)3,溶液中,逐滴加入1.0mol·L-1NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列有关说法正确的是
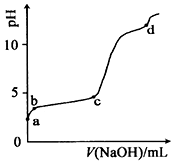
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH-
Al(OH)3
B.a~b段,溶液pH增大,A13+浓度不变
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
难度: 简单查看答案及解析
-
常温下,Ksp(CaSO4)=9×10-6,CaSO4在水中的沉淀溶解平衡曲线如图。下列说法正确的是
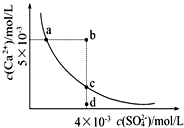
A.在任何溶液中,若有 CaSO4沉淀析出,则c(Ca2+) 与c(SO42-)一定相等
B.d点溶液通过蒸发可以变到c点
C.a点对应的Ksp等于c点对应的Ksp
D.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol·L -1
难度: 简单查看答案及解析
-
20mL0.1mol/LFeCl3溶液中含有部分Fe2+,向其中滴加NaOH溶液至PH=4,溶液中有沉淀生成,过滤,得沉淀和滤液。已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Fe(OH)2]=8.0×10-16。下列说法错误的是
A.沉淀中只有Fe(OH)3 B.沉淀中有Fe(OH)3和Fe(OH)2
C.滤液c(Fe3+)=4.0×10-8mol/L D.向滤液中滴加FeCl2溶液,无沉淀产生
难度: 困难查看答案及解析
-
下列说法正确的是
A.pH均为2的醋酸加水稀释100倍,所得溶液的pH:醋酸>盐酸
B.pH为11的氨水和pH为3的盐酸溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.浓度均为0.1 mol/L的NaOH溶液和CH3COONa溶液等体积混合后的溶液: c(Na+) + c(CH3COO-)= c(OH-)+c(H+)
D.浓度均为0.1mol/L的醋酸和CH3COONa溶液等体积混合,溶液中有下列关系:c(CH3COOH) + 2c(H+) = c(CH3COO-)+ 2c(OH-)
难度: 简单查看答案及解析