-
化学与生活、生产密切相关。下列叙述错误的是
A.过氧化钠可用作呼吸面具中的供氧剂
B.向海水中加净水剂明矾可使海水淡化
C.使用含有氯化钙的融雪剂会加速桥梁的腐蚀
D.服用抗氧化剂维生素C有利于人体对铁元素的吸收
难度: 简单查看答案及解析
-
化学与生产和生活密切相关。下列过程中没有发生化学变化的是
A.氯气作水杀菌消毒剂 B.硅胶作袋装食品的干燥剂
C.二氧化硫作纸浆的漂白剂 D.肥皂水作蚊虫叮咬处的清洗剂
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列叙述不正确的是
A.常温常压下,17g甲基(—14CH3)所含的中子数为8NA
B.0.1molFe与0.1molCl2充分反应,转移的电子数为0.2NA
C.标准状况下,44.8LNO与22.4LO2混合后气体的分子总数为2NA
D.1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA
难度: 困难查看答案及解析
-
下列说法正确的是
A.氯水和二氧化硫都具有漂白作用,两者漂白原理相同
B.等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等
途径a:Cu→
CuO
CuSO4;途径b:Cu
CuSO4
C.用金属钠可区分乙醇和乙醚
D.从海水中提取物质都必须通过化学反应才能实现
难度: 中等查看答案及解析
-
已知NaOH+Al(OH)3→Na[Al(OH)4]。向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。上述实验过程中没有发生的离子反应是
A.CO2+2OH-=CO32-+H2O
B.Al2O3+2OH-+3H2O=2[Al(OH)4]-
C.2 Al+2OH-+6H2O=2 [Al(OH)4]-+3H2↑
D.Al3++4OH-=[Al(OH)4]-
难度: 简单查看答案及解析
-
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是

难度: 简单查看答案及解析
-
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是
A. 简单离子半径:W<X<Z
B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性:W<Y
D. 最高价氧化物的水化物的酸性:Y>Z
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.向Na2O2中加入足量水:2Na2O2+2H2O=4Na++4OH-+O2↑
B.向Ag(NH3)2NO3溶液中加入盐酸:Ag(NH3)2++2H+=Ag++2NH4+
C.向Al2(SO4)3溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓
D.向Ca(HCO3)2溶液中加入澄清石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
难度: 简单查看答案及解析
-
下列说法不正确的是
A.储热材料是一类重要的能量存储物质,单位质量的储热材料在发生熔融或结晶时会吸收或释放较大的热量
B.Ge(32号元素)的单晶可以作为光电转换材料用于太阳能电池
C.Ba2+浓度较高时危害健康,但BaSO4可服人体内,作为造影剂用于X-射线检查肠胃道疾病
D.纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附
难度: 中等查看答案及解析
-
制备(NH4)2Fe(SO4)2·6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理。常温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是
A.通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42-
B.加入少量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO-
C.加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH-
D.加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH-
难度: 中等查看答案及解析
-
化学在生活中有着广泛的应用,下列对应关系错误的是
化学性质
实际应用
A
Al2(SO4)3和小苏打反应
泡沫灭火器灭火
B
铁比铜金属性强
FeCl3腐蚀Cu刻制印刷电路板
C
次氯酸盐具有氧化性
漂白粉漂白织物
D
HF与SiO2反应
氢氟酸在玻璃器皿上刻蚀标记
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3:4。W-的最外层为8电子结构。金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是
A. X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应
B. 原子半径大小:X<Y,Z>W
C. 化合物Z2Y和ZWY3都只存在离子键
D. Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂
难度: 简单查看答案及解析
-
下列各组物质的熔点均与所含化学键的键能有关的是
A.CaO与CO2 B.NaCl与HCl C.SiC与SiO2 D.Cl2与I2
难度: 简单查看答案及解析
-
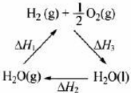
通过以下反应均可获取H2。下列有关说法正确的是
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) △H1=571.6kJ·mol-1
②焦炭与水反应制氢:C(s)+ H2O(g) =CO(g)+ H2(g) △H2=131.3kJ·mol-1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g) △H3=206.1kJ·mol-1
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,△H3减小
D.反应CH4(g)=C(s)+2H2(g)的△H=74.8kJ·mol-1
难度: 简单查看答案及解析
-
分类法是一种行之有效、简单易行的科学方法。某同学用如表所示的形式对所学知识进行分类,其中甲与乙、丙、丁是包含关系。
甲
乙、丙、丁
①
常见干燥剂
浓硫酸、石灰石、碱石灰
②
常见合金
不锈钢、青铜、生铁
③
腐蚀品
浓硫酸、烧碱、硝酸
④
碱性氧化物
过氧化钠、氧化镁、硝酸
⑤
弱电解质
醋酸、一水合氨、水
其中正确的组合是
A.①② B.③④⑤ C.②③⑤ D.①④⑤
难度: 中等查看答案及解析
-
向胶体中加入电解质能使胶体凝聚。使一定量的胶体在一定时间内开始凝聚所需电解质的浓度称作“聚沉值”,电解质的“聚沉值”越小,表示其凝聚力越大。实验证明,凝聚力主要取决于和胶粒带相反电荷的离子所带的电荷数,电荷数越大,凝聚力越大,则向Fe(OH)3胶体中加入下列电解质时,其“聚沉值”最小的是
A.NaCl B.FeCl3 C.K2SO4 D.Na3PO4
难度: 中等查看答案及解析
-
对反应A+B=AB来说,常温下按以下情况进行反应:
①20mL溶液中含A、B各0.01mol ②50mL溶液中含A、B各0.05mol
③0.1mol•L-1的A、B溶液各10mL ④0.5mol•L-1的A、B溶液各50mL
四者反应速率的大小关系是
A.②>①>④>③ B.④>③>②>①
C.①>②>④>③ D.①>②>③>④
难度: 中等查看答案及解析
-
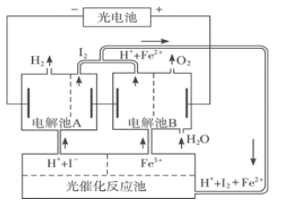
截止到2013年12月末,中国光伏发电新增装机容量达到10.66GW,光伏发电累计装机容量达到17.16GW,图为光伏并网发电装置电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。下列叙述中正确的是

A.N型半导体为正极,P型半导体为负极
B.制氢装置溶液中电子流向:从B极流向A极
C.X2为氧气
D.工作时,A极的电极反应式为CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O
难度: 困难查看答案及解析
-
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:
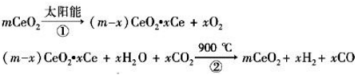
下列说法不正确的是
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.右图中△H1=△H2+△H3
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH――2e-═CO32-+2H2O
难度: 中等查看答案及解析
-
有关NaHCO3和Na2CO3的性质,以下叙述错误的是
A.等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下Na2CO3产生的CO2体积小
B.等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3的两倍
C.等质量NaHCO3和Na2CO3与盐酸完全反应,前者消耗盐酸较多
D.等物质的量的NaHCO3和Na2CO3与足量盐酸反应产生CO2一样多
难度: 简单查看答案及解析
-
某水溶液只可能含有K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-中的若干种离子。某同学取100ml的溶液分成两等份进行如下实验:
①第一份加过量的氢氧化钠溶液后加热,收集到0.02mol的气体,无沉淀产生,同时得到溶液甲。
②向溶液甲中通过量的二氧化碳气体,生成白色沉淀,沉淀经过滤,洗涤灼烧后,得到1.02g固体。
③第二份加足量的氯化钡溶液后,生成白色沉淀,沉淀经盐酸充分洗涤,干燥,得到 11.65g固体。
据此,该同学得到的结论正确的是
A.实验①中产生的气体为氨气,并可得原溶液中c(NH4+)=0.2 mol·L-1
B.实验③中的白色沉淀中一定有BaSO4,无BaCO3
C.原溶液中一定有K+,且c(K+)=0.4 mol·L-1
D.若要判断原溶液中是否有Cl-,无需另外设计实验验证
难度: 困难查看答案及解析
-
某反应过程中体系的能量变化如图所示,下列说法错误的是

A.反应过程可表示为 A+BC→[A…B…C] →AB+C
(反应物)(过渡态)(生成物)
B.E1为反应物的总能量与过渡态的能量差,称为正反应的活化能
C.正反应的热效应为△H=E1—E2<0 ,所以正反应为放热反应
D.此图中逆反应的热效应△H=E1—E2<0,所以逆反应为放热反应
难度: 中等查看答案及解析
-
已知:2Na[Al(OH)4]+CO2=2Al(OH)3↓+Na2CO3+H2O。向含2molNaOH、1molBa(OH)2、2molNa[Al(OH)4]的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系不正确的是
选项
A
B
C
D
n(CO2)(mol)
2
3
4
6
n(沉淀)(mol)
1
2
3
2
难度: 中等查看答案及解析
-
电渗析法是指在外加电场作用下,利用阴离子交换膜和阳离子交换膜的选择透过性,使部分离子透过离子交换膜而迁移到另一部分水中,从而使一部分水淡化而另一部分水浓缩的过程。如图是利用电渗析法从海水中获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为石墨电极。下列有关描述错误的是
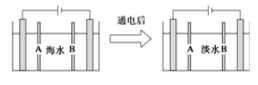
A.阳离子交换膜是A,不是B
B.通电后阳极区的电极反应式:2Cl――2e-→Cl2↑
C.工业上阴极使用铁丝网代替石墨碳棒,以增强导电性
D.阴极区的现象是电极上产生无色气体,溶液中出现少量白色沉淀
难度: 困难查看答案及解析