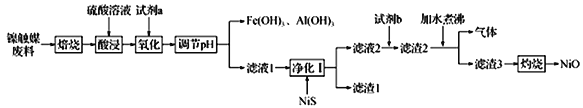
-
Na2O2具有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能发生反应。为了验证此推测结果,该同学设计并进行如下实验。
I.实验探究
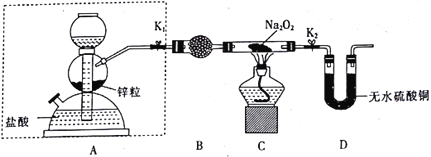
步骤1:按如图所示的装置组装仪器(图中夹持仪器已省略)并检查装置的气密性,然后装入药品。
步骤2:打开K1、K2,在产生的氢气流经装有Na2O2的硬质玻璃管的过程中,未观察到明显现象。
步骤3:进行必要的实验操作,淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝色。
(1)组装好仪器后,要检查装置的气密性。简述检查虚线框内装置气密性的方法:________。
(2)B装置中所盛放的试剂是_____,其作用是_______。
(3)步骤3中的必要操作为打开K1、K2,_______(请按正确的顺序填入下列步骤的字母)。
A.加热至Na2O2逐渐熔化,反应一段时间
B.用小试管收集气体并检验其纯度
C.关闭K1
D.停止加热,充分冷却
(4)由上述实验可推出Na2O2与H2反应的化学方程式为__________。
II.数据处理
(5)实验结束后,该同学欲测定C装置硬质玻璃管内白色固体中未反应完的Na2O2含量。
其操作流程如下:

①测定过程中需要的仪器除固定、夹持仪器外,还有电子天平、烧杯、酒精灯、蒸发皿和____。
②在转移溶液时,若溶液转移不完全,则测得的Na2O2质量分数_____(填“偏大”“偏小”或“不变”)
难度: 困难查看答案及解析