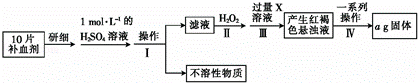
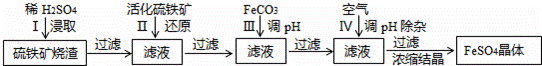
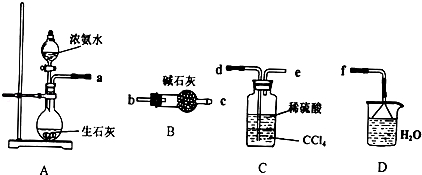
-
现有常温下的四份溶液:①0.01mol•L﹣1 CH3COOH溶液;②0.01mol•L﹣1盐酸;③pH=12的氨水;④pH=12的NaOH溶液.下列说法正确的是
A.①中水的电离程度最小,③中水的电离程度最大
B.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:④最大
C.将四份溶液稀释相同倍数后,溶液的pH:③>④,②>①
D.将②、③混合,若pH=7,则消耗溶液的体积:②<③
难度: 简单查看答案及解析
-
如表为某有机物与各种试剂的反应现象,则这种有机物可能是
试剂
钠
溴水
NaHCO3溶液
现象
放出气体
褪色
放出气体
A.CH2═CH﹣CH2﹣OH B.

C.CH2═CH﹣COOH D.CH3COOH
难度: 中等查看答案及解析
-
金属材料在日常生活、生产中有着广泛的运用,下列关于金属的说法不正确的是
A.工业上金属Mg、Al都是用电解熔融的氯化物制得的
B.合金的性质与其成分金属的性质不完全相同
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼
难度: 中等查看答案及解析
-
在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是
A.p(Ne)>p(H2)>p(O2) B.p(O2)>p(Ne)>p(H2)
C.p(H2)>p(O2)>p(Ne) D.p(H2)>p(Ne)>p(O2)
难度: 中等查看答案及解析
-
已知2Fe3++2I﹣=I2+2Fe2+、Br2+2Fe2+=2Fe3++2Br﹣.现向含有FeBr2、FeI2的某溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色,则下列叙述中正确的是
①按Br2、Fe3+、I2的顺序氧化性逐渐减弱
②原溶液中Br﹣一定被氧化
③通入氯气后原溶液中的Fe2+一定被氧化
④不能确定通入氯气后的溶液中是否还存在Fe2+
⑤若取少量所得溶液,加入CCI4后静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中Fe2+、Br﹣均被完全氧化.
A.①②③④ B.①③④⑤ C.②④⑤ D.①②③④⑤
难度: 简单查看答案及解析
-
相等物质的量的KClO3分别发生下述反应:①有MnO2催化剂存在时,受热分解得到氧气;②若不使用催化剂,加热至470℃左右,得到KClO4(高氯酸钾)和KCl.下列关于①和②的说法不正确的是
A.都属于氧化还原反应 B.发生还原反应的元素相同
C.发生氧化反应的元素不同 D.生成KCl的物质的量为2:1
难度: 简单查看答案及解析
-
下列离子方程式书写不正确的是
A.硫酸铜溶液和氢氧化钠溶液反应:Cu2﹣+2OH﹣═Cu(OH)2↓
B.盐酸和氢氧化钠溶液反应:H++OH﹣═H2O
C.碳酸钙和盐酸溶液:CO32﹣+2H+═H2O+CO2↑
D.氢氧化钡和硫酸的反应:Ba2++2OH﹣+2H++SO42﹣═2H2O+BaSO4↓
难度: 简单查看答案及解析