-
有关氧化还原反应的叙述正确的是 ( )
A.氧化还原反应的实质是有氧元素的得失
B.氧化还原反应的实质是元素化合价的升降
C.氧化还原反应的实质是电子的转移(得失或偏移)
D.物质所含元素化合价升高的反应是还原反应
难度: 简单查看答案及解析
-
X原子的质子数为m,X2-和Y3+的核外电子数相等,则Y原子的核电荷数是( )
A、m+1 B、m+3 C、m+5 D、 m-5
难度: 简单查看答案及解析
-
相同温度和压强下,等质量的下列气体中体积最小的是 ( )
A.O2 B.NO C.N2 D.CO2
难度: 简单查看答案及解析
-
下列化学式可称为分子式的是 ( )
A.NaNO3 B.NH4Cl C.H2SO4 D.SiO2
难度: 简单查看答案及解析
-
砹是原子序数最大的卤族元素,推测砹或砹的化合物最不可能具有的性质是( )
①砹化氢很稳定 ②砹单质与水反应,使砹全部转化成氢砹酸和次砹酸
③砹是黑色固体 ④砹化银难溶于水 ⑤砹易溶于某些有机溶剂
A.只有①② B.只有①②⑤ C.只有③⑤ D.只有②⑤
难度: 简单查看答案及解析
-
人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变为Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有 ( )
A.酸性 B.碱性 C.氧化性 D.还原性
难度: 简单查看答案及解析
-
0.5mol氢气和0.5mol碘晶体完全反应,生成1mol碘化氢气体,吸收26.5 kJ 的热,则下列热化学方程式正确的是 ( )
A. H2(g) + I2(s)
2HI(g) - 26.5kJ
B. H2 + I2
2HI - 53kJ
C. H2(g) + I2(s)
2HI(g) - 53kJ
D. 0.5H2 + 0.5I2
HI - 26.5kJ
难度: 简单查看答案及解析
-
2005年3月29日京沪高速淮安段发生一起特大交通事故,一辆载有液氯的铁罐车因轮胎爆炸造成大量液氯泄漏,给当地居民的生活和环境造成严重污染。下列有关说法合理的是 ( )
A.液氯泄漏将当地大片庄稼熏黄,这是由于Cl2的漂白性所致
B.泄漏的液氯应该用大量碱液中和
C.液氯泄漏后立即挥发成氯气而扩散到空气中,故事故现场不必进行特别的处理
D.这次事故说明液氯不能用铁罐盛装
难度: 简单查看答案及解析
-
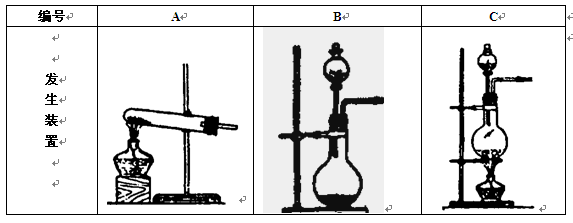
已知
难溶于
,如下图所示,下列装置中,不适宜于
气体尾气吸收的是 ( )
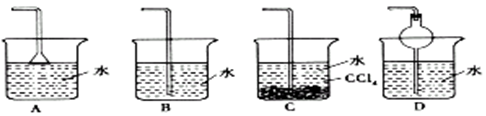
难度: 简单查看答案及解析
-
下列有关气体体积的叙述中,正确的是 ( )
A.在一定温度和压强下,各种气态物质的体积大小由构成气体的分子大小决定
B.在一定温度和压强下,各种气态物质的体积大小由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数一定不同
D.气体摩尔体积是指lmol任何气体所占的体积约为22.4升
难度: 简单查看答案及解析
-
若用X代表F、Cl、Br、I四种卤族元素,下列属于它们共性反应的是( )
A.X2+H2 → 2HX B.X2+H2O → HX+HXO
C.2Fe+3X2 → 2FeX3 D.X2+2NaOH → NaX+NaXO+H2O
难度: 简单查看答案及解析
-
下列变化中,必须加入氧化剂才能发生的是 ( )
A.SO2→S B.SO32—→SO2 C.I—→I2 D.HCO3—→CO32—
难度: 简单查看答案及解析
-
向某CuSO4饱和溶液中加入含18O的无水CuSO4粉末xg,如温度不变,其结果是( )
A、无水CuSO4不会溶解,xg粉末质量不变。
B、含18O的SO42-进入溶液,白色粉末变成蓝色晶体,其质量大于xg
C、含18O的SO42-进入溶液,白色粉末变成蓝色晶体,其质量等于xg
D、溶解平衡被破坏,达到新的平衡时有部分含18O的SO42-进入溶液,固体粉末小于xg
难度: 简单查看答案及解析
-
在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是: ( )
A.加入有色布条,一会儿有色布条褪色,说明溶液中有C12存在
B.溶液呈黄绿色,且有刺激性气味,说明有C12分子存在
C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明有C1—存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HC1O分子存在
难度: 简单查看答案及解析
-
下列各物质熔点由高到低的顺序正确的是……………………… ( )
① MgO ② NaCl ③ KBr ④ HCl ⑤ H2O
A、①②③⑤④ B、①②③④⑤ C、④⑤①②③ D、③②①④⑤
难度: 简单查看答案及解析
-
在盛少量氯水的试管中加入过量的溴化钾溶液,再加少量汽油,振荡静止后( )
A.溶液为紫色 B.汽油层呈橙色 C.汽油层呈紫红色 D.溶液为橙色
难度: 简单查看答案及解析
-
(CN)2、(OCN)2、(SCN)2等通称为拟卤素,它们的性质与卤素相似,氧化性强弱顺序是:
F2>(OCN)2>Cl2>(CN)2>(SCN)2>I2 下列方程式中错误的是( )
A.2NaSCN+MnO2+2H2SO4
Na2SO4+(SCN)2↑+MnSO4+2H2O
B.(CN)2+2KI
2KCN+I2
C.Cl2+2NaOCN
(OCN)2+2NaCl D.2AgCN
2Ag+(CN)2
难度: 简单查看答案及解析
-
有一瓶无色气体,可能含有HCl、H2S、CO2、HBr、SO2中的一种或几种,将其通入氯水中,得到无色透明溶液,把溶液分成两份,向一份加入盐酸化的BaCl2溶液,出现白色沉淀,另一份加入HNO3酸化的AgNO3溶液,也有白色沉淀,以下结论正确的是( )
(1)原气体中肯定有SO2(2)原气体中可能有SO2(3)原气体中肯定没有H2S、HBr (4)不能肯定原气体中是否有HCl (5)原气体中肯定没有CO2 (6)原气体中肯定有HCl
A.(1)(3)(4) B.(2)(4)(5)
C.(1)(3)(6) D.(1)(3)(5)(6)
难度: 简单查看答案及解析
-
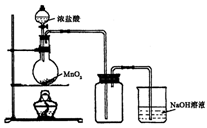
浓盐酸和氯酸钾的反应如下:KClO3 + 6HCl
KCl + 3Cl2+ 3H2O其中发生氧化反应的氯原子和发生还原反应的氯原子的质量比是 ( )
A.1∶6 B.1∶5 C.5∶1 D.6∶1
难度: 简单查看答案及解析
-
将0.2molMnO2和含0.6molHCl的浓盐酸混合后加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为(不考虑盐酸的挥发) ( )
A、等于0.3mol B、小于0.3mol
C、大于0.3mol,小于0.6mol D、等于0.6mol
难度: 简单查看答案及解析