-
参照反应Br+H2→HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )
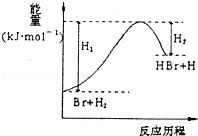
A.正反应为放热反应
B.加入催化剂,该化学反应的反应热不变
C.反应物总能量高于生成物总能量
D.升高温度可增大正反应速率,降低逆反应速率
难度: 中等查看答案及解析
-
在一密闭容器中充入1molNO2气体,建立如下平衡:2NO2
N2O4,测得NO2转化率为a%,在温度、体积不变时,再通入1molNO2,待新平衡建立时,测得 NO2转化率为b%,则a与b比较( )
A.a>b B.a<b C.a=b D.无法确定
难度: 中等查看答案及解析
-
在密闭容器中发生下列反应aA(g)
cC(g)+dD(g),压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A.A的转化率变大 B.平衡向正反应方向移动
C.D的体积分数变大 D.a<c+d
难度: 中等查看答案及解析
-
下列各组热化学方程式中,化学反应的△H1大于△H2的是( )
①C(s)+O2(g)═CO2(g)△H1; C(s)+
O2(g)═CO(g)△H2
②2H2(g)+O2(g)═2H2O(g)△H1; 2H2(g)+O2(g)═2H2O(l)△H2
③H2(g)+Cl2(g)═2HCl(g)△H1;
H2(g)+
l2(g)═HCl(g)△H2
④CaCO3(s)═CaO(s)+CO2(g)△H1; CaO(s)+H2O(l)═Ca(OH)2(s);△H2.
WA.①③ B.①④ C.②④ D.②③
难度: 中等查看答案及解析
-
下列事实一定能证明HNO2是弱电解质的是( )
①常温下NaNO2溶液pH大于7 ②用HNO2溶液做导电实验,灯泡很暗
③HNO2和NaCl不能发生反应 ④0.1mol•L﹣1HNO2溶液的pH=2.1[
⑤NaNO2和H3PO4反应,生成HNO2 ⑥0.1mol•L﹣1HNO2溶液稀释至100倍,pH约为3.1
A.①④⑥ B.①②③④ C.①④⑤⑥ D.全部
难度: 中等查看答案及解析
-
化学反应A2+B2═2AB的能量变化如图所示,则下列说法正确的是( )
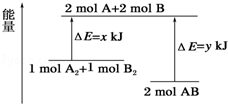
A.该反应是吸热反应
B.断裂1mol A﹣A键和1mol B﹣B键能放出xkJ的能量
C.断裂2mol A﹣B键需要吸收ykJ的能量
D.2mol AB的总能量高于1 mol A2和1mol B2的总能量
难度: 中等查看答案及解析
-
下列叙述能说明反应2A(g)+B(g)
2C(g)已达平衡状态的有( )
①A、B、C的百分含量相等;
②单位时间,消耗a mol B,同时生成2a mol C;
③单位时间,消耗a mol A,同时生成0.5a mol B;
④外界条件不变时,物质总质量不随时间改变;
⑤外界条件不变时,气体总分子数不再变化;
⑥A、B、C分子数之比为2:1:2.
A.除④外 B.除②⑥外 C.②④⑤ D.③⑤
难度: 中等查看答案及解析
-
已知:2X+Y
2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是( )

A.T 1时,v正>v逆
B.正反应的△H<0
C.a、b两点的反应速率 v( a)=v( b)
D.T<T1时,ω增大的原因是平衡向正方向移动
难度: 中等查看答案及解析
-
已知某反应aA(g)+bB(g)
cC(g)△H=Q 在密闭容器中进行,在不同温度(T1和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是( )

A.T1<T2,P1<P2,a+b>c,Q<0 B.T1>T2,P1<P2,a+b<c,Q>0
C.T1<T2,P1>P2,a+b<c,Q>0 D.T1<T2,P1>P2,a+b>c,Q<0
难度: 中等查看答案及解析
-
俄罗斯用“质子﹣M”号运载火箭成功将“光线”号卫星送入预定轨道。发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:

(1)H2(g)=H2(l)△H1=﹣0.92kJ•mol﹣1
(2)O2(g)=O2(l)△H2=﹣6.84kJ•mol﹣1
(3)如图:下列说法正确的是( )
A.2mol H2(g)与1mol O2(g)所具有的总能量
比2molH2O(g)所具有的总能量低
B.氢气的燃烧热为△H=﹣241.8 kJ•mol﹣1
C.火箭液氢燃烧的热化学方程式2H2(l)+O2(l)═2H2O(g)△H=﹣474.92kJ•mol﹣1
D.H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量
难度: 中等查看答案及解析
-
在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发 生反应:H2(g)+Br2(g)
2HBr(g)△H<0. 当温度分别为T1、T2,平衡时, H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )
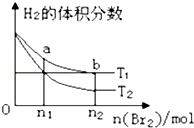
A.由图可知:T2>T1
B.a、b两点的反应速率:b>a
C.为了提高Br2(g)的转化率,可采取增加Br2 (g)通入量的方法
D.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加
难度: 困难查看答案及解析
-
对可逆反应2A(s)+3B(g)
C(g)+2D(g);△H<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动
②增大B的浓度,v(正)>v(逆)
③压强增大一倍(压缩体积),平衡不移动,v(正)、v(逆)不变
④升高温度,平衡向逆反应方向移动,v(逆)增大、v(正)减小
⑤加入催化剂,B的转化率提高
A.①② B.② C.③④ D.④⑤
难度: 中等查看答案及解析
-
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)
2C(g)△H=﹣192kJ•mol﹣1。向M、N中,都通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )
A.平衡时A气体在两容器中体积分数可能相等
B.若x:y=1:2,则平衡时,M中的转化率:A>B
C.若x:y=1:3,当M中放出热量172.8 kJ时,A的转化率为90%
D.若x=1,y=3,则达到平衡时反应物的转化率N<M
难度: 困难查看答案及解析
-
已知NO2与N2O4相互转化:2NO2(g)
N2O4(g);△H=﹣24.2kJ/mol。在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图。下列推理分析合理的是( )
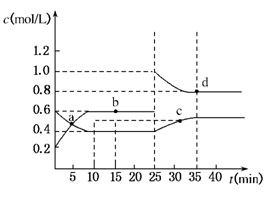
A.a,b,c,d四点中V正与V逆均相等
B.反应进行到10min时,体系吸收的热量为9.68kJ
C.前10min内,用v(NO2)表示的该反应速率为0.02mol/L•min
D.25min时,导致平衡移动的原因是升温
难度: 困难查看答案及解析
-
已知723K时,2SO2(g)+O2(g)
2SO3(g)△H=﹣QkJ/mol,在相同条件下,向一密闭容器中通入2mol SO2和1mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2kJ。则Q1、Q2、Q满足的关系是( )
A.Q2=
B.Q2>
C.Q2<Q1<Q D.Q=Q1>Q2
难度: 中等查看答案及解析
-
关于化学平衡常数的叙述正确的是( )
A.浓度一定,一个化学反应的平衡常数是一个常数
B.两种物质反应,不管怎样书写化学方程式,平衡常数不变
C.温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数
D.浓度商Qc<Kc,v(正)<v(逆)
难度: 中等查看答案及解析
-
反应E+F==G在温度T1下进行,反应M+N==K在温度T2下进行,已知T1>T2,且E和F的浓度均大于M和N的浓度(其他条件均相同),则两者的反应速率( )
A.前者大 B.后者大 C.一样大 D.无法判断
难度: 简单查看答案及解析
-
已知:在一定温度下,H2(g)+I2(g)=2HI(g)的平衡常数为K1;
H2(g)+
I2(g)
HI(g)的平衡常数为K2,则K1、K2的关系为( )
A.K1=K2 B.K1=2K2 C.K1=1/2K2 D.K1=K22
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是( )
A.向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化

B.向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b

C.催化剂能改变化学反应的焓变

D.等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)⇌N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0

难度: 困难查看答案及解析
-
一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS﹣)=1×10﹣5mol•L﹣1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:
c(Na+)+c(H+)=c(OH﹣)+c(HC2O4-)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
难度: 困难查看答案及解析
-
将BaO2放入密闭真空容器中,反应2BaO2(s)
2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
A.平衡常数减小 B.BaO量不变 C.氧气压强不变 D.BaO2量减少
难度: 中等查看答案及解析
-
可逆反应N2(g)+3H2(g)
2NH3(g),500℃时在容积为10L的密闭容器中进行,开始时加入1mol N2和6mol H2,则达到平衡时,NH3的浓度不可能达到( )
A.0.1 mol•L﹣1 B.0.2 mol•L﹣1 C.0.05 mol•L﹣1 D.0.15 mol•L﹣1
难度: 中等查看答案及解析
-
一定条件下,对于可逆反应X(g)+3Y(g)
2Z(g),若X、Y、Z的起始浓度分别为 c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,则下列判断正确的是( )
A.c1:c2=3:1 B.平衡时,Y和Z的生成速率之比为2:3
C.X、Y的转化率相等 D.c1的取值范围为0.04 mol/L<c1<0.14 mol/L
难度: 中等查看答案及解析
-
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂 1mol N﹣N键吸收193kJ热量,断裂 1mol N≡N键吸收941kJ热量,则下列说法不正确的是( )

A.N4与N2互为同素异形体
B.1 mol N4气体转化为N2时要放出724 kJ能量
C.N4变成N2是化学变化
D.N4不可能是分子晶体
难度: 中等查看答案及解析
-
密闭容器中充入一定量的NO2,发生反应2NO2(g)
N2O4(g)△H=﹣57kJ•mol﹣1。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化
的曲线如图所示。下列说法正确的是( )
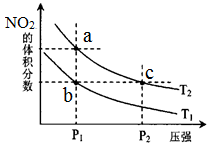
A.a、c两点的反应速率:a>c
B.a、b两点的转化率:a<b
C.a、c两点气体的颜色:a深,c浅
D.由a点到b点,可以用加热的方法
难度: 困难查看答案及解析