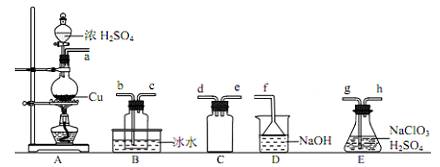
-
《中国诗词大会》不仅弘扬了中国传统文化,还蕴含着许多化学知识,下列诗词分析不正确的是
A. 李自诗句“日照香炉生紫烟,遥看瀑布挂前川”, “紫烟”指“香炉”中碘升华的现象
B. 刘禹锡诗句“千淘万漉虽辛苦,吹尽狂沙始到金”,金性质稳定,可通过物理方法得到
C. 王安石诗句“爆竹声中一岁除,春风送暖入屠苏”,爆竹的燃放涉及氧化还原反应
D. 曹植诗句“煮豆燃豆萁,豆在釜中泣”,这里的能量变化主要是化学能转化为热能。
难度: 中等查看答案及解析
-
下列关于元素及其化合物的说法不正确的是
A.Fe在一定条件下可与浓盐酸、稀硫酸、浓硝酸等剧烈反应
B.Al、Cl2均能和NaOH溶液发生氧化还原反应,且两单质的作用不相同
C.在稀硫酸中加入铜粉,铜粉不溶解,若再继续加入KNO3固体,铜粉会溶解
D.金属单质Na、Mg、Fe在一定条件下与水反应都生成H2和相应的碱
难度: 简单查看答案及解析
-
下列表示物质或微粒的化学用语或模型正确的是
A. 中子数为8的碳原子:
B. S2-的结构示意图:

C. 二氧化碳电子式:
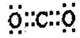 D. 氮气的结构式:N-N
D. 氮气的结构式:N-N难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 5.6gFe在氧气中燃烧,完全反应时转移电子数为0.3NA
B. 标准状况下,4.48L氦气中所含原子数为0.2NA
C. NA个Fe(OH)3胶体粒子的质量为107g
D. 常温下,l.7gNH3和3,65gHCl混合后,气体分子数为0.2NA
难度: 简单查看答案及解析
-
利用右图所示装置进行下列实验,其中丙中实验现象描述正确的是
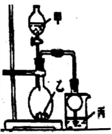
实验
试剂甲
试剂乙
试剂丙
丙中的现象
A
70%硫酸
Na2SO3
紫色石蕊试液
溶液先变红后褪色
B
浓盐酸
KMnO4
含酚酞的NaOH溶液
溶液褪色
C
稀盐酸
CaCO3
BaCI2溶液
有白色沉淀生成
D
浓氨水
CaO
AlCl3
先生成白色沉淀然后沉淀溶解
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
用下列装置不能达到实验目的的是( )
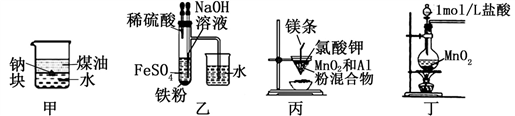
A. 用甲图装置可证明ρ(煤油)< ρ(钠) < ρ(水) B. 用乙图装置制备Fe(OH)2
C. 用丙图装置制取金属锰 D. 用丁图装置制取氯气
难度: 中等查看答案及解析
-
下列各组澄清溶液中离子能大量共存,且加入(或滴入)X试剂后发生反应的离子方程式书写正确的是
选项
离子组
X试剂
离子方程式
A
K+、H+、SO42-
少量Ba(OH)2
Ba2++OH-+H++SO42-=BaSO4↓+H2O
B
Fe2+、Cl-、H+
少量NaNO3
3Fe2++NO3-+4H+=NO↑+2H2O+3Fe3+
C
Na+、Fe3+、NO3-
过量KSCN
Fe3++3SCN-=Fe(SCN)3↓
D
NH4+、H+、HCO3-
过量NaOH
NH4++H++HCO3-+3OH-=NH3·H2O+2H2O+CO32-
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
含氯消毒液(主要成分NaClO)与含氯洁厕灵(主要成分HCl)混用可能会造成中毒,其原因是:NaClO+HCl= Cl2↑+NaCl+ H2O。下列说法中正确的是
A. NaCl是还原产物
B. NaClO只含有离子键
C. 当释放(标况下)2.24L Cl2时,一定有6.02×1022个氯分子扩散到室内
D. 使用消毒液时滴加食醋可加快作用发挥,其原因用离子方程式表示为 ClO-+CH3COOH=HClO+CH3COO-
难度: 简单查看答案及解析
-
现有易溶强电解质的混合溶液10L,其中可能含有K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如下明所示,下列说法正确的是
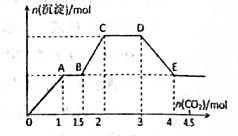
A.该溶液中能确定存在的离子是Ba2+、AlO2-、NH4+
B.肯定不存在的离子是SO42-、OH-
C.若不能确定的离子中至少还存在着一种阳离子,则该离子的最小浓度为0.2 mol/L
D.OA段反应的离子方程式:2 AlO2-+ CO2+3H2O=2Al(OH)3↓+CO32-
难度: 困难查看答案及解析
-
下列能说明氯元素比硫元素非金属性强的是
①HC1比H2S稳定 ②HClO4酸性比H2SO4强 ③Cl2能与H2S反应生成s ④Cl2比S更易与H2化合生成相应气态氢化物 ⑤盐酸是强酸,而氢硫酸是弱酸
A. ①②③④⑤ B. ①②④⑤ C. ①②③④ D. ②④⑤
难度: 简单查看答案及解析
-
应用元素周期律分析,下列推断正确的是
A. 砹(At)是第VIIA族元素,其氢化物的稳定性大于HCl
B. 铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
C. 第2周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
D. 第3周期金属元素最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱
难度: 简单查看答案及解析
-
主族元素镓(Ga)的原子结构示意图是:
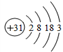 ,下列关系不正确的是
,下列关系不正确的是A. 原子半径: K > Ga > Al
B. 碱性: KOH > Ga(OH)3 > Al(OH)3
C. 离子的氧化性: K + > Ga3+ > Al3+
D. 与水反应的剧烈程度: K > Ga > Al
难度: 中等查看答案及解析
-
短周期元素 W、X、Y、Z 的原子序数依次递增,a、b、c、d、e、f 是由这些元素组成的化合物,d 是淡黄色粉末,m 为元素 Y 的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法错误的是

A. 简单离子半径:Z<Y
B. 阴离子的还原性:Y>W
C. 简单气态氢化物的热稳定性:Y>X
D. W2Y2 中含有非极性键
难度: 中等查看答案及解析
-
a、b、c、d为原子序数依次增大的四种短周期主族元素。a的最外层电子数是内层电子数的3倍,b的M层上有1个电子,a与c同主族。下列说法不正确的是
A. 简单阴离子还原性:d>c B. 气态氢化物稳定性:a>c
C. 原子半径:b>c>d D. ab可形成既含离子键又含共价键的离子化合物.
难度: 简单查看答案及解析
-
下列图示变化为吸热反应的是
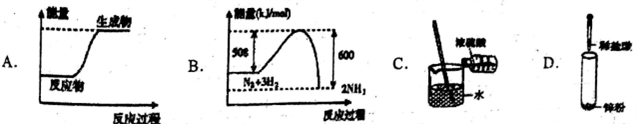
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列变化过程中,原物质分子内共价键被破坏,同时有离子键形成的是
A.盐酸和NaOH溶液混合 B.氯化氢溶于水
C.溴化氢气体与氨气相遇反应 D.锌和稀硫酸反应
难度: 中等查看答案及解析
-
白磷结构如右图所示,与O2反应生成P4O6的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则该分子含有共价键的数目是
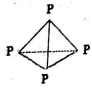
A. 10 B. 12 C. 24 D. 28
难度: 简单查看答案及解析
-
全氮类物质具有高密度、超高能量及爆炸产物无污染等优点。中国科学家成功合成全氮阴离子N5-,N5-是制各全氮类物质N5+N5-的重要中间体。下列说法中,不正确的是
A. 全氮类物质属于绿色能源 B. 每个N5+中含有35个质子
C. 每个N5-中含有35个电了 D. N5+N5-结构中含共价键
难度: 简单查看答案及解析
-
用100mL2mol/L稀硫酸与过量铁片反应制取氢气时,下列措施能使氢气的生成的速率增大而产生氢气的量不变的是
A. 给反应体系适当加热 B. 向反应体系中加水稀释 C. 加入少量氧化铜固体 D. 加压
难度: 简单查看答案及解析
-
一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+B(g)
2C(g)+D(s)已达到平衡状态的是
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体总物质的量 ⑤混合气体的平均相对分子质量 ⑥混合气体的总质量 ⑦混合气体的总体积
A. ②③⑤⑥ B. ①②③⑤⑥ C. ①②③⑤⑦ D. ②③④⑤
难度: 简单查看答案及解析
-
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是
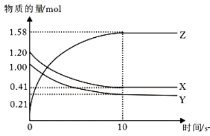
A.反应开始到10s,用Z表示的反应速率为0.158 mol/(L·s)
B.反应开始到10s,X的物质的量浓度减少了0.79 mol/L
C.反应开始到10s,Y的转化率为79.0%
D.反应的化学方程式为X(g)+Y(g)
Z(g)
难度: 简单查看答案及解析
-
经一定时间后,可逆反应aA+bB
cC中物质的含量A%和C%随温度的变化曲线如图所示。下列说法正确的是( )
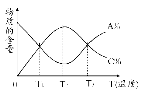
A.该反应在T1、T3温度时达到化学平衡
B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动
难度: 中等查看答案及解析