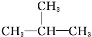-
化学与生活密切相关,下列说法不正确的是
A.乙烯可作水果的催熟剂
B.硅胶可作袋装食品的干燥剂
C.二氧化硫可作食品的漂白剂
D.氢氧化铝可作胃酸的中和剂
难度: 简单查看答案及解析
-
下列有关有机化合物的组成和结构的叙述中,正确的是( )。
A.仅由碳、氢两种元素组成
B.有机化合物分子中可存在碳碳单键,也可以存在碳碳双键或碳碳叁键或碳环
C.丙烯(CH2=CH—CH3)分子中所有原子都在同一平面上
D.聚乙烯的结构简式为CH2===CH2
难度: 中等查看答案及解析
-
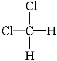
欲制取较纯净的CH2ClCH2Cl(即1,2-二氯乙烷),最合理的方法是
A.CH3CH3与Cl2取代 B.CH2===CH2与HCl加成
C.CH2===CH2与Cl2加成 D.CH3CH2Cl与Cl2取代
难度: 中等查看答案及解析
-
常温下,下列各种物质既能使溴水退色,又能使酸性KMnO4溶液退色,并且化学反应原理不相同的是( )。
A.CH2===CH2 B.SO2 C.H2 D.CH3CH3
难度: 中等查看答案及解析
-
能鉴别CO2和SO2的试剂是
A.紫色石蕊试液 B.氯化钡溶液
C.酸性高锰酸钾溶液 D.澄清石灰水
难度: 中等查看答案及解析
-
能把苯、四氯化碳、酒精、己烯四种物质区别开来的一种试剂是( )
A.碳酸钠 B.溴水 C.水 D.石蕊试液
难度: 中等查看答案及解析
-
下列除去杂质的操作中,能达到目的的是( )
A. 除去苯中的少量溴:加入CCl4萃取后分液
B. 除去乙烷中的乙烯:通入酸性高锰酸钾溶液中
C. 除去CO2中的少量HCl气体:通过盛有饱和Na2CO3溶液的洗气瓶
D. 除去FeCl2溶液中的少量FeCl3:加入足量Fe粉后过滤
难度: 中等查看答案及解析
-
分子式为C7H16的烃,其中最长链上有5个碳原子的同分异构体有
A.4种 B.5种 C.6种 D.7种
难度: 困难查看答案及解析
-
使1 mol乙烯与氯气完全发生加成反应,然后使该加成反应的产物与氯气在光照条件下发生完全取代反应,则两个过程中消耗氯气的总物质的量是( )
A.3 mol B.4 mol C.5 mol D.6 mol
难度: 中等查看答案及解析
-
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
A.加热
B.不用稀硫酸,改用98%的硫酸
C.滴加少量CuSO4溶液
D.不用铁片,改用铁粉
难度: 中等查看答案及解析
-
航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为2NH4ClO4
N2↑+4H2O+Cl2↑+2O2↑,反应放热,下列对此反应叙述中错误的是( )。
A.生成物的总能量小于反应物的总能量
B.上述反应瞬间产生大量的高温气体推动航天飞机飞行
C.反应从能量变化上讲,主要是化学能转变为热能和动能
D.在反应中高氯酸铵只作氧化剂
难度: 中等查看答案及解析
-
据报道,我国拥有完全自主产权的氢氧燃料电池车已在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关该电池的叙述不正确的是( )
A.正极反应式为:O2+2H2O+4e-===4OH-
B.工作一段时间后,电解液中KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2===2H2O
D.该电池工作时每消耗1 mol O2,有2 mol电子转移
难度: 中等查看答案及解析
-
汽车的启动电源常用铅蓄电池。其结构如下图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4===2PbSO4+2H2O根据此反应判断下列叙述中正确的是( )
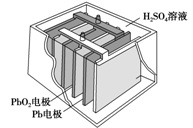
A.PbO2是电池的负极
B.SO42-向Pb极移动
C.PbO2得电子,被氧化
D.电池放电时,溶液酸性增强
难度: 中等查看答案及解析
-
下列有关原子结构和元素周期律表述正确的是( )
①原子序数为15的元素的最高化合价为+3
②ⅦA族元素是同周期中非金属性最强的元素
③第二周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第三周期ⅡA族
⑤H和D原子中的质子数和中子数都不相等
A. ①②⑤ B. ②③ C. ②④ D. ③④⑤
难度: 中等查看答案及解析
-
已知aA+、bB2+、cC-、dD2-四种离子均具有相同的电子层结构,关于A、B、C、D四种元素的叙
述正确的是 ( )
A. 原子半径:A>B>C>D
B. 原子序数:b>a>d>c
C. 离子半径:D>C>A>B
D. 失电子能力:B>A,得电子能力:D>C
难度: 中等查看答案及解析
-
下列分子中不满足所有原子最外层为8电子结构的是
A.CCl4 B.AlCl3 C.PCl3 D.CO2
难度: 中等查看答案及解析
-
在下列变化中,有共价键被破坏的是
A.碘升华 B.HCl溶于水
C.Zn跟硫酸铜溶液发生反应 D.电解熔融NaCl
难度: 中等查看答案及解析
-
关于卤素的下列叙述正确的是( )
A. 卤素是典型的非金属元素,因此不能与其他非金属元素化合
B. 卤素单质越活泼,其熔沸点就越高
C. 卤素各单质都能和水剧烈反应
D. 卤素单质都能和H2反应,且气态氢化物的稳定性随单质氧化性的增强而增强
难度: 中等查看答案及解析
-
下列对碱金属的叙述,其中完全不正确的组合是( )
①K通常保存在煤油中,以隔绝与空气的接触
②碱金属常温下呈固态,取用时可直接用手拿
③碱金属中还原性最强的是钾
④碱金属阳离子,氧化性最强的是Li+
⑤碱金属的原子半径和离子半径都随核电荷数的增大而增大
⑥从Li到Cs,碱金属的密度越来越大,熔、沸点越来越高
A. ②③⑥ B. ②③④ C. ④⑤⑥ D. ①③⑤
难度: 中等查看答案及解析
-
氯的原子序数为17,37Cl和35Cl是氯的两种同位素,下列说法正确的是( )
A. 35Cl原子所含质子数为18 ,37Cl和35Cl得电子能力相同
B.
mol的H35Cl分子所含中子数约为6.02×1023
C. 7 g的35Cl2气体的体积为2.24 L
D. 35Cl的相对原子质量是12C原子质量的35倍
难度: 困难查看答案及解析
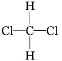 和
和